专题∣临床评价到底有没有捷径?
发布于:2015-06-25 16:38
2015年5月19日,RA小伙伴儿们千呼万唤的《医疗器械临床试验评价指导原则》终于发布。
《临床评价指导原则》万众瞩目的原因在于:《医疗器械注册管理办法》将申请第二类、第三类器械注册的产品分为:需进行临床试验和免于进行临床试验2大类。
这让许多企业决策者眼前一亮,认为通过“与同品种医疗器械临床试验或临床使用获得的数据进行分析评价”申请是一条“捷径”。唯有RA小伙伴们心头一紧,因为同品种医疗器械临床试验或临床使用数据到底是什么鬼,需要比较哪些方面,比较到什么程度全是未知数。
《医疗器械临床试验评价指导原则》颁布以后,对“同品种医疗器械临床数据分析”给出了具体要求。恰似一盆冷水泼下来,因为同品种医疗器械对比真的是太!难!了!有!木!有!
先来概要的看一下《医疗器械临床试验评价指导原则》都说了些什么:
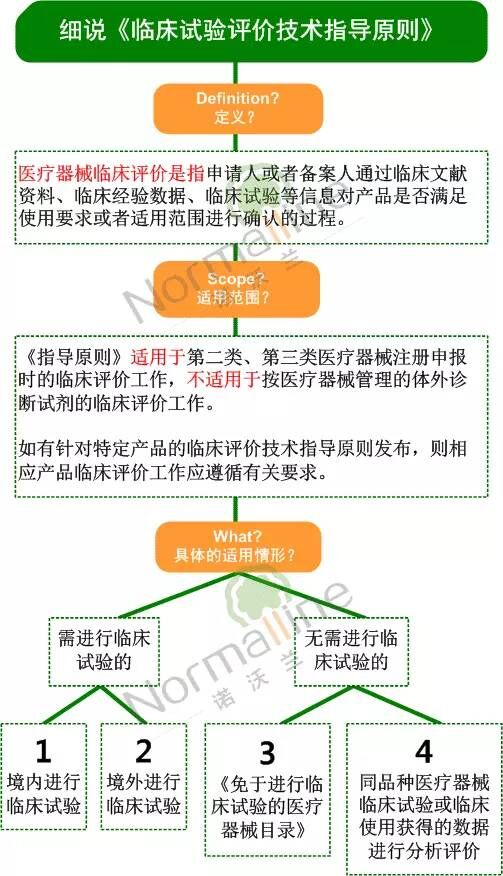
从上图中可以看出“申请第二类、第三类器械注册的产品”分为需进行临床试验和免于进行临床试验的2类。
需进行临床试验的又分为在中国境内进行临床试验,和在境外进行临床试验等2种情况。
而免于进行临床试验的又分为属于《免于进行临床试验的医疗器械目录》和与同品种产品对比等2种情况。
转自:CMDRA
相关文章:





 京公网安备 11010102002968号
京公网安备 11010102002968号