详解监督抽验“复检”征求意见
发布于:2016-01-04 13:44
2015年12月24日,国家食品药品监督管理总局发布了《关于征求加强医疗器械监督抽验复检工作有关意见的函》(食药监械监便函[2015]137号)。
征求背景
2015年12月22日,总局刚刚发布了2015年第3期质量公告,公布了对一次性使用输液器-带针等65个品种990批(台)产品的质量监督抽验和跟踪抽验结果。同时公式了质量监督抽验不符合标准规定的66家医疗器械生产企业名单。
我国现行的《医疗器械质量监督抽查检验管理规定》(食药监械监〔2013〕212号)自2013年10月11日起实施。
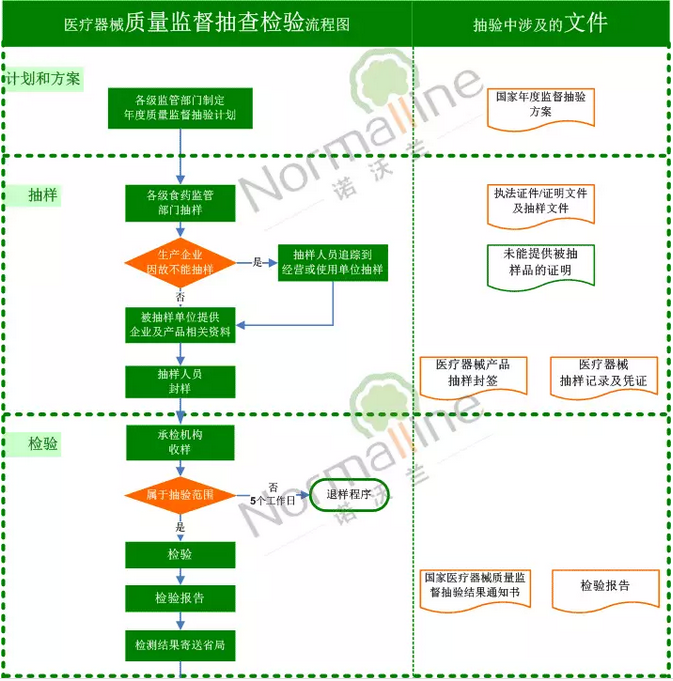
抽查检验流程
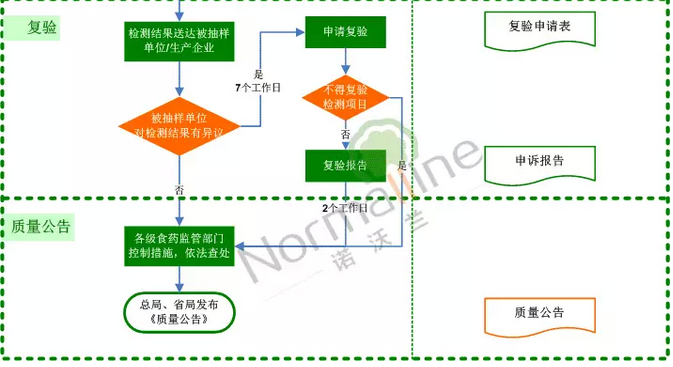
此次征求内容是针对上述流程中的“复检”环节。通常情况下,被抽样单位或标示生产企业对检验结果有异议的,可以自收到检验报告之日起7个工作日内向具有相应资质的医疗器械检验机构提出复验申请。
《征求意见稿》要点提示
1.复验回避原则
复检申请人应自收到检验报告之日起7个工作日内向具有相应资质的检验机构提出复检申请,但原则上不得向属地检验机构和注册检验机构提出复检申请,因检验资质等原因无法回避的情况除外。
2.不予复验的情形
(一)不宜复检的检验项目(如:破坏性试验等);
(二)难以复现的检验项目(如:环氧乙烷残留量等);
(三)样品超过有效期的;
(四)其他原因导致样品无法实现复检的。
《征求意见稿》原文
为加强和完善医疗器械质量监督抽查检验(以下简称监督抽验)工作,进一步规范复检工作,征求意见如下:
一、监督抽验的复检工作应严格按照《医疗器械质量监督抽查检验管理规定》(食药监械监〔2013〕212号)执行。申请复检的标示生产企业或被抽样单位(以下简称复检申请人)向医疗器械检验机提出复检申请时,应提交如下资料:一是《医疗器械抽验复检申请表》(以下简称复检申请表);二是注册检验报告;三是检验结果送达告知书原件及复印件。
二、检验机构收到复检申请时,应根据检验结果送达告知书确认申请是否有效,确认本单位是否具有相应产品和检验项目的检验资质及能力,确认申请复检项目是否属于“不予复检”项目等,并于当日决定是否受理,在复检申请表中给出是否受理复检的明确意见,将复检申请表复印件当场交复检申请人。复检机构不得无故拒绝复检申请人的复检申请。
三、复检申请人不得同时向多家检验机构提出复检申请。复检机构的选择应当遵循以下原则:
(一)回避原则。复检申请人应自收到检验报告之日起7个工作日内向具有相应资质的检验机构提出复检申请,但原则上不得向属地检验机构和注册检验机构提出复检申请,因检验资质等原因无法回避的情况除外。
(二)优先原则。在遵循回避原则的前提下,复检申请人可优先向产品类别归属的标准化技术委员会挂靠单位提出复检申请。
四、医疗器械监督抽验方案中,对于存在以下情形之一的不予复检:
(一)不宜复检的检验项目(如:破坏性试验等);
(二)难以复现的检验项目(如:环氧乙烷残留量等);
(三)样品超过有效期的;
(四)其他原因导致样品无法实现复检的。
五、接受复检机构应向原检机构出具公函,调取样品及相关资料,原检机构应予以配合,并于收到公函之日起5个工作日内移交样品及相关资料,并同时提交原检验过程及结果判定依据等说明材料。
六、复检机构应按原判定原则和检验报告规范进行检验,并出具复检报告。复检结论与原检结论一致的,可直接出具检验报告;复检结论与原检结论不一致的,复检机构在出具检验报告时,应另附材料对复检过程及结果判定依据进行说明,存档备查。复检申请人对检验结果有异议,异议原因与检验有关且不能由复检解决的,可以书面向省局提出申诉。
各省、自治区、直辖市食品药品监督管理部门要积极组织直属单位、行业协会、行政相对人等相关单位广泛征求意见,并统一汇总,在2016年1月15日前反馈我司。各省局、应将建议或意见的纸质版邮寄或传真至我司,并将电子版发送至指定邮箱;其他单位或人员的意见可以电子邮件、传真等方式报送。
转自:CMDRA





 京公网安备 11010102002968号
京公网安备 11010102002968号