大咖论介入:聚焦IVUS,专家共识告诉我们什么?丨GW-ICC2020
发布于:2020-10-27 18:14

血管内超声(IVUS)作为腔内影像学技术,历经30多年的发展已成为导管室必备的工具,且与介入心脏病学的发展息息相关。目前,中国IVUS的应用现状如何?IVUS的临床应用价值几何?有哪些注意事项?在长城心脏病学大会(GW-ICC2020)“腔内影像与功能:指南解读与临床启示”专场,来自中国医学科学院阜外医院的钱杰教授结合2017血管内超声临床应用的中国专家共识就此做了专题解析。
IVUS应用现状
回顾中国近十年经皮冠状动脉介入治疗(PCI)情况,我国开展PCI数量年平均增长率高达15%左右,并于2017年成为开展PCI数量第一大国,IVUS使用率也不断增加。分析IVUS的地区应用情况可见,其主要分布于东部经济发达地区,相对集中于中大型城市(图1)。
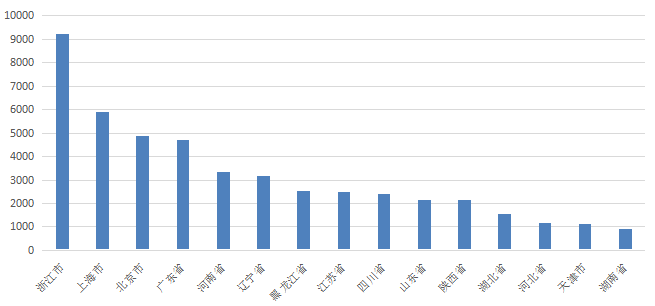
图1. 2019年中国IVUS开展前15位省份(来自:bostonscientific.com)
需要强调的是,虽然我国IVUS应用不断增加,但与国外相比仍存在较大差距。2018年调查数据显示,我国介入领域整体IVUS渗透率仅为6%,显著低于日本(90%)、韩国(约20%)以及欧美国家(约20%)。是否被医保覆盖是影响IVUS渗透率的重要因素。据统计,目前IVUS的主要应用场景包括左主干、钙化及慢性完全闭塞性(CTO)病变。预计未来中国IVUS渗透率将达到20%以上。
专家共识解读
近三年来,欧洲心血管介入协会(EAPCI)制定并发布了“引导优化冠脉介入手术”专家共识和“急性冠脉综合征、血管造影评估模糊的造影、指导介入决策制定”专家共识两大共识。此外《血管内超声在冠状动脉疾病中应用的中国专家共识(2018)》也已发表(图2)。下文将就中国专家共识内容做详细分析与解读。
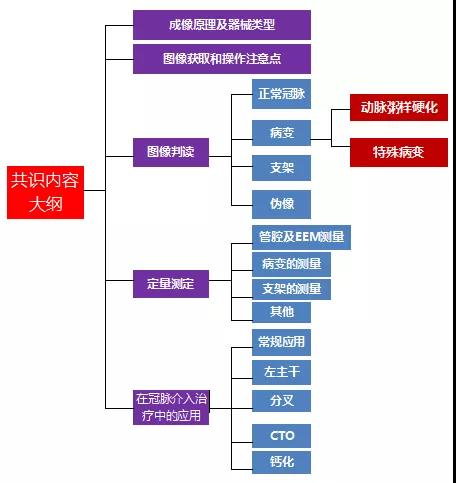
图2. 《血管内超声在冠状动脉疾病中应用的中国专家共识(2018)》主要内容
IVUS成像原理与器械类型
目前,比较常用的IVUS成像器械类型主要是采用相控阵式探头或机械式探头。虚拟组织学IVUS成像的应用相对不是太广泛,主要用于一些研究中。

图3. IVUS成像原理与器械类型
IVUS图像获取的控制及操作技术
IVUS图像获取的控制与操作要注意和强调基本功。
首先,要做好术前准备,注意肝素的应用,可使用硝酸甘油以减少痉挛从而真实反映血管的大小。
其次,要做好导管的准备,做好冲洗,注意去除环晕伪像。
再次,还需要调整景深和增益来使用不同血管的管径并调整图像,从而获取清晰的信号。
此外,导管回撤也有技巧,例如应尽可能使用自动回撤以获得病变长度,常用的回撤速度是0.5mm/s,部分特殊病变还要注意自动回撤与手动回撤相结合。
另外,图像分析时需要注意长轴与短轴的结合。
最后,需要强调的是,还应注意冠脉痉挛、气栓、夹层、冠脉急性闭塞等相关并发症,可使用防治痉挛的药物和注意轻柔操作以减少并发症的发生。
IVUS图像判读
IVUS所示的正常冠脉的血管影像可见3层组织,两个分界面,即管腔-内膜交界面和中膜-外膜交界面(图4)。
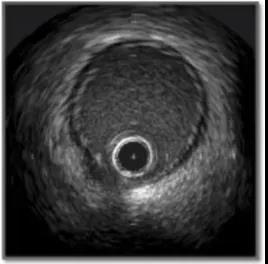
图4. IVUS所示的正常冠脉的血管影像
冠状动脉粥样硬化斑块IVUS成像时,可将斑块内回声与血管周围代表外膜或外膜组织的回声进行比较从而分为低回声斑块、致密回声斑块、钙化斑块和混合斑块等不同类型(图5)。
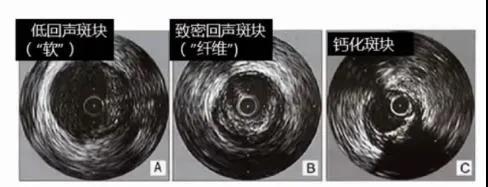
图5. IVUS可识别冠状动脉粥样硬化斑块的类型
但是,需要注意的是,传统灰阶IVUS对“易损斑块”缺乏明确的定义。早期研究认为,能够检出斑块破裂和“易损斑块”;其特征包括斑块内低回声区面积>1mm2,斑块内低回声区占斑块的面积比>20%,纤维帽的厚度<0.7mm。
另外,对于一些特殊病变或置入物如血栓、夹层、动脉瘤、心肌桥、血管真假腔以及支架等,IVUS也能予以识别。
IVUS定量测量
IVUS测量要做好边界的识别,主要是利用冠脉壁的两个面即管腔内膜界面和外弹力膜界面。在确定管腔边界后,可开始下一步,测量最小管腔横截面积、最小和最大管腔直径、管腔偏心率和管腔面积狭窄等。不过,就外弹力膜的测量而言,光学相干断层成像(OCT)相对会更准确。
IVUS还可用于测量动脉粥样硬化病变以便了解斑块管腔边界包绕区域面积(CSA)、斑块厚度、斑块偏心率及斑块负荷。对于钙化,IVUS虽然不能测量钙化的厚度,但可进行半定量测定以了解钙化的长度、是表面钙化还是深层钙化。对于支架,应用IVUS可了解支架CSA、最大及最小支架直径、支架对称性及其偏心指数、支架扩张细数。另外,IVUS还可评价血管重构、测量病变长度。需要特别强调的是,依靠传统的血管造影难以鉴别血管重构和动脉粥样硬化(图6),IVUS则能提供非常有价值的信息,有助于指导精准治疗。

图6. 传统血管造影难以鉴别的血管重构和动脉粥样硬化(EEM:血管外弹力膜)
IVUS在冠脉介入中的应用
首先,IVUS用于支架置入前病变的分析与判断,能够对病变程度、性质、累及范围进行精准判断。需要强调的是,IVUS所测量的最小管腔面积(MLA)只能用来估测血管的缺血情况,而血流储备分数(FFR)可作为判断缺血的标准。
其次,IVUS可用于支架置入后的评估。早期金属裸支架置入理想的IVUS标准包括支架完全贴壁、支架内最小CSA≥平均参考CSA的90%、偏心指数≥0.7。在DES时代,支架扩张无疑是预后主要的指标。IVUS评估所示的支架内最小管腔面积≤5mm2、支架边缘斑块负荷≥50%、支架边缘夹层、弥漫的支架贴壁不良均是远期不良事件的独立预测因素。
再次,IVUS对于左主干病变、分叉病变、CTO病变、钙化病变等特殊病变有着重要的指导价值。对于左主干病变,采用IVUS评估时需要从LAD及LCX分别回撤,这一点非常重要。此外,IVUS还可指导左主干病变单支架及双支架的选择。对于分叉病变,IVUS可明确分叉病变的性质、斑块负荷的分布及形态,对单支架及双支架式的决定有着很大的指导作用,对于术中导丝的走行也有着重要的指导意义,还能观察支架扩张情况及支架边缘夹层从而优化远期效果。
对于CTO病变,IVUS可以对闭塞病变起始部进行识别、判断和探寻真腔。在反向CART技术中,其可明确正逆向导丝的空间关系。此外,IVUS还可测量CTO病变血管的直径及长度,选择支架置入的位置从而优化远期结果。对于钙化病变,IVUS有助于判断钙化位置及钙化角度,指导旋磨头的选择及旋磨。
最后,IVUS对于自发性夹层、外伤性夹层、衰减斑块、支架断裂等也有评估价值。
对IVUS局限性的客观认识
虽然IVUS在中国仍存在广阔的应用空间,但我们也需要客观认识其固有的局限性。首先,IVUS不能直接进行功能学评价。其次,受分辨率的限制,IVUS难以分辨斑块纤维帽、微小的内膜撕裂及糜烂、小血栓等结构。因此,临床实践中我们可采用IVUS与其他腔内影像学及功能学检测手段相结合以提供更完整的组织学及功能学信息。





 京公网安备 11010102002968号
京公网安备 11010102002968号