【指南与共识】光学相干断层成像技术在冠心病介入诊疗领域的应用中国专家建议
发布于:2017-02-10 11:19 点击下载
本文刊于:中华心血管病杂志, 2017,45(01): 5-12
作者: 中华医学会心血管病学分会介入心脏病学组 心血管病影像学组
光学相干断层成像(optical coherence tomography,OCT)是继血管内超声(intravascular ultrasound,IVUS)后出现的一种新的冠状动脉内成像技术。与IVUS相比,OCT有极高的分辨率,在评价易损斑块和指导支架置入,尤其是在急性冠状动脉综合征(acute coronary syndrome, ACS)等冠心病诊疗领域日益受到关注。在欧洲心脏病学学会(ESC)2013年的稳定性冠心病管理指南中,OCT对于评估病变特征及优化支架置入过程均为Ⅱb类推荐(证据水平为B),总体证据水平等同于IVUS[1]。在ESC/欧洲心胸外科协会(EACTS)2014年的心肌再血管化指南中,将OCT对优化经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的推荐等级提升到与IVUS等同的Ⅱa类[2]。2015年发表的ILUMIENⅠ研究表明,PCI术前和(或)术后行OCT检查可影响术者的介入治疗策略[3] 。近期的ILUMIEN Ⅱ研究结果表明,OCT在指导支架膨胀方面不劣于IVUS[4]。因此,国内长期从事冠状动脉介入诊疗及影像学研究、有丰富冠心病介入诊疗临床经验的心血管病专家通过循证医学回顾并结合临床实际经验,共同制定OCT成像方法、图像分析以及应用指征的中国专家建议,旨在规范并指导OCT在冠心病诊疗领域中的应用。
一、OCT技术概述
OCT技术是一种应用近红外光干涉的成像技术,其原理是通过记录不同深度生物组织的反射光,由计算机构建出易于识别的血管图像。2010年,第3代频域OCT(frequency domain OCT, FD-OCT)系统采用频域成像技术使成像速度提高达10倍,横向分辨率和图像质量更高,使其在冠心病介入诊疗领域迅速推广。最新一代ILUMEIN和ILUMEIN OPTIS系统成像速度更快,并整合血流储备分数(FFR)功能,同时具备形态学和功能学评估功能,扩展了OCT的应用指征。OCT是目前分辨率最高的腔内影像学技术,应用中存在的主要问题是:穿透力有限,当斑块负荷过大时,影响对病变严重性的评估、血管外膜的识别和斑块负荷的测定;对左右冠状动脉开口病变的评价能力有限,但是与术者经验以及临床操作有关。OCT与IVUS的成像特点比较见表1。

二、OCT系统的构成及图像采集过程
目前C7-XR OCT广泛应用于临床,以下主要介绍C7-XR OCT成像系统的构成及图像采集过程。
(一)OCT成像系统的构成
1.组件构成:
C7-XR OCT成像系统包括集成到移动推车中的以下组件:成像引擎、显示器、驱动马达和光学控制器(DOC)、隔离变压器、计算器、键盘和鼠标。
2.成像导管:
C7 Dragonfly成像导管。C7 Dragonfly成像导管工作长度为135 cm,外径2.7 F,采用亲水涂层设计,操控性能好。在成像导管头端及距离头端20 mm处各有1个不透X光的专用标记物,用于定位和评估长度。光学透镜距离近端标志5 mm。
(二)OCT图像采集过程
1.成像前准备:
在进行OCT成像之前,应常规进行肝素化抗凝。如无禁忌证,应在冠状动脉内给予硝酸甘油100~200 μg,以防止导管诱发的冠状动脉痉挛。具备下列情况者行OCT检查时需谨慎:(1)严重左心功能不全或血液动力学不稳定;(2)多支病变,或仅剩1支有功能的冠状动脉;(3)对对比剂过敏以及严重肾功能不全。对于次全闭塞或完全闭塞冠状动脉,或血流TIMI分级在2级及以下者,最好恢复前向血流至TIMI 3级,再行OCT检查。
2.OCT图像的获取:
对C7-XR OCT成像系统进行初始设置及创建新病例后,即可准备C7 Dragonfly成像导管,并将成像导管连接至DOC,获取测试图像及验证校准后即可开始图像采集。成像时将OCT导管通过指引导丝送至靶病变或支架远端,在OCT导管前端距离扫描光源10 mm的位置有1个X线下可视的专用标记物,操作者可通过成像导管中的不透光光纤的位置定位扫描起始点。在临床操作中,OCT应用的主要问题是无法穿透血流(红细胞)成像,因此操作过程中需要冲洗管腔中的血流,清除管腔中的红细胞。通过指引导管快速注射晶体溶液或对比剂(通常选择对比剂),以达到清除血液的目的。一般来说,左冠状动脉成像通常需推注6~8 ml对比剂,右冠状动脉成像通常需推注4~5 ml对比剂。术者和OCT操作者应做好密切配合,在快速推注对比剂之前,应推注少量对比剂以再次确认导管的同轴性,应尽量保证单次冲刷完成成像,避免多次对比剂冲洗,减少对比剂用量。
3.影响成像质量的常见因素:
影响OCT成像质量的常见因素如下:(1)指引导管未同轴;(2)推注对比剂速度缓慢或推注量不足;(3)术者推注对比剂与图像采集不同步;(4)C7 Dragonfly成像导管内有血液或气泡残留;(5)推注的对比剂中掺有血液;(6)对比剂浓度过低;(7)导丝或导管弯曲和折断;(8)冠状动脉直径过大(直径>5.0 mm)和开口病变;(9)严重弯曲钙化病变成像导丝易损坏,并且成像有伪像。
三、OCT图像的定义
以下OCT图像的定义为单一横截面图像的识别。
(一)正常血管壁
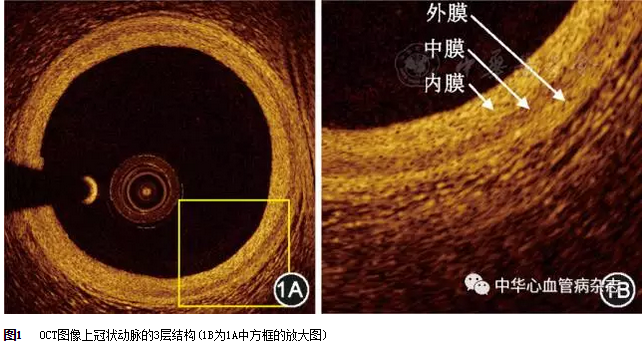
在OCT图像上,正常冠状动脉血管壁的特征是典型的3层结构,由内膜、中膜和外膜组成(图1)。内膜主要为弹力纤维层,反射信号高,表现为高信号亮带状;中膜为平滑肌层,反射信号通常较低或信号微弱,表现为信号较低暗带;外膜主要为细胞外基质和外弹力膜,表现为信号较强但不均一亮带。在OCT图像上,内弹力膜的定义是动脉内膜和中膜的边界,而外弹力膜的定义是动脉中膜和外膜的边界。
(二)动脉粥样硬化斑块
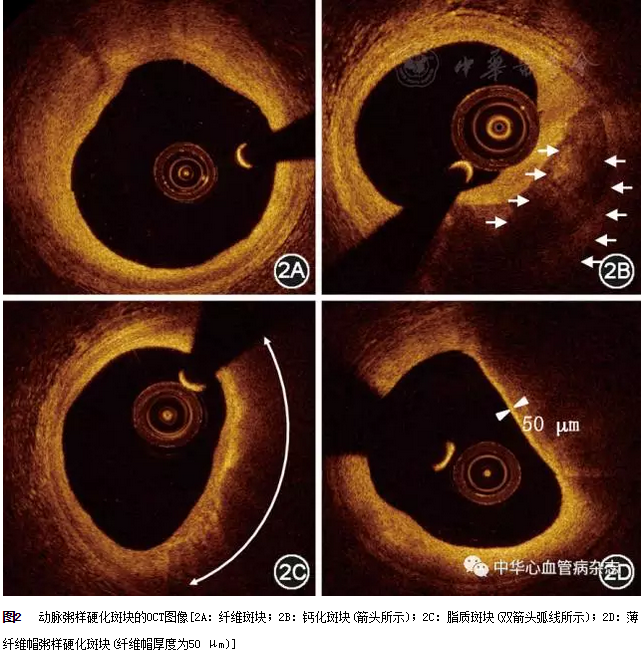
在OCT图像上,动脉粥样硬化斑块的定义是血管壁出现占位性病变(增厚病变)或血管壁3层结构缺失。OCT图像上的斑块类型可分为3类,即纤维斑块、钙化斑块和脂质斑块。
在OCT图像上,纤维斑块表现为同质、高信号和弱衰减区域,有时可在纤维斑块中发现内弹力膜或外弹力膜(图2A)。在OCT图像上,钙化斑块表现为边缘锐利的低信号或不均匀区域(图2B)。该定义适用于较大的钙化,一些特殊类型的钙化,如微小或点状钙化,可能与斑块稳定性相关[5],但其OCT定义尚未确立。在OCT图像上,脂质斑块表现为边缘模糊、高背反射和强衰减区域,在低信号区域的表面有高信号带的纤维帽(图2C)。
薄纤维帽粥样硬化斑块:在OCT图像上,薄纤维帽粥样硬化斑块是指纤维帽厚度≤ 65 μm的富含脂质斑块(图2D)[6]。
(三) OCT对斑块细微结构的识别
在OCT图像上,纤维帽是指覆盖在低信号区域(脂质或钙化)上的组织层,它的反射信号通常较高。
巨噬细胞在OCT图像上的特征为高反射、强衰减的点状或条带状结构,且常在高信号的点状区域后形成放射状光影(图3A)。
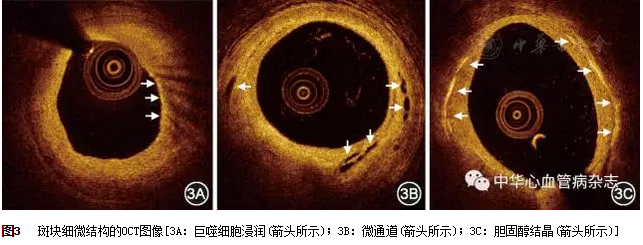
微通道在OCT图像上的特征为直径50~300μm、信号低和边缘锐利的空洞样结构,通常可以在多个(至少3个)连续截面中观察到(图3B)。
在OCT图像上,胆固醇结晶表现为信号强度较高、衰减较低的薄线性区域,通常位于纤维帽或脂质斑块坏死核心中与脂质伴行(图3C)。目前,关于OCT检测胆固醇结晶的敏感度和特异度,还有待进一步研究。
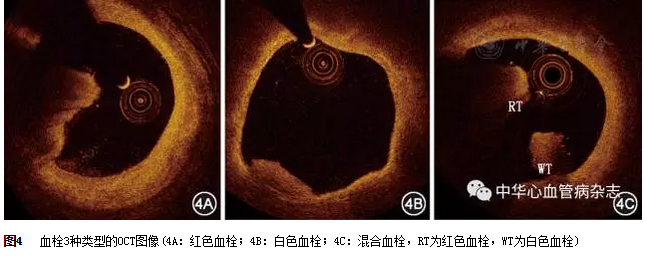
在OCT图像上,血栓表现为附着在管腔表面或在管腔内漂浮的不规则团块。其分为以下3种类型:(1)红色血栓(富含红细胞):高背反射和强衰减性(图4A);(2)白色血栓(富含血小板):低背反射,信号均匀,弱衰减性(图4B);(3)混合血栓:介于红色血栓与白色血栓之间(图4C)。
(四)解读OCT图像时的注意事项
1.由成像系统或其他原因造成的图像畸变或相对真实解剖结构的差异称为OCT伪像。常见的OCT伪像有血液残留、错层伪像、气泡伪像、切线伪像、饱和伪像和导丝损坏等(图5)。
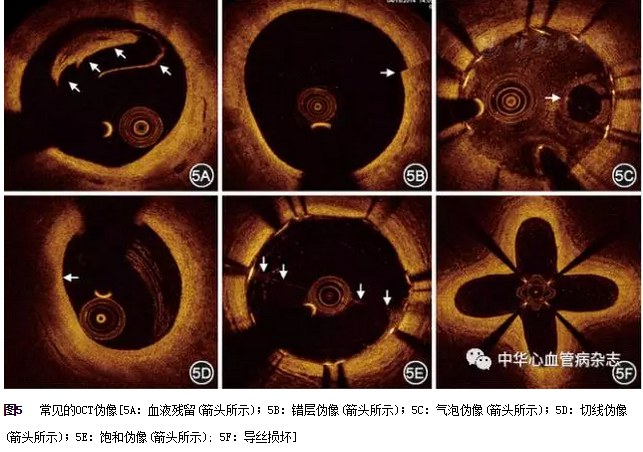
2.脂质斑块应与钙化斑块相鉴别,前者边缘模糊或难以辨认,而后者边缘锐利。此外,某些斑块的特定成分如巨噬细胞,也会造成OCT信号的强衰减,并在后方呈现出低信号图像;浅层(切线)的信号衰减、血液或红色血栓也可形成类似脂质斑块的伪影。
3.一般来说,巨噬细胞通常在纤维帽和脂质池边界聚集。位于斑块浅层的巨噬细胞会影响对其所覆盖的斑块成分的评价,并形成类似脂质坏死核心的图像。当巨噬细胞与微小钙化、胆固醇结晶或内外膜同时出现时,对图像识别也可能会造成混淆。
四、OCT的临床应用
(一)OCT在易损斑块诊疗中的作用
易损斑块是指不稳定、易于形成血栓和突然破裂而导致急性心血管事件的斑块[6],其主要病理学特征是大的脂质坏死核心、薄纤维帽并伴有巨噬细胞浸润[6]。薄纤维帽粥样硬化斑块是易损斑块的主要类型之一,OCT定义下的薄纤维帽粥样硬化斑块与病理学有高度的吻合性[7],是斑块快速进展的独立预测因子[8]。一项结合OCT与IVUS的临床研究表明,纤维帽厚度<52 μm和斑块负荷>76%是斑块破裂的临界点[9] 。
早期发现易损斑块并进行药物干预,有助于降低心血管事件风险。OCT研究发现,他汀类药物可显著增加脂质斑块纤维帽厚度,减少纤维帽中巨噬细胞含量[10,11,12],从而稳定易损斑块,改善冠心病患者的临床预后[13,14]。
(二)OCT在ACS诊疗中的价值
1.OCT对ACS罪犯病变的判定:
研究表明,造成ACS的3个主要病理学机制为斑块破裂、斑块侵蚀和钙化结节[6]。其在OCT图像上的特征如下:(1)斑块破裂:纤维帽连续性中断,伴空腔形成(图6A、图6B)。(2)斑块侵蚀:根据斑块表面是否有血栓及其所覆盖斑块的能见度,将斑块侵蚀分为明确的OCT-斑块侵蚀和可能的OCT-斑块侵蚀[15]。明确的OCT-斑块侵蚀的定义为纤维帽完整,未见斑块破裂,伴血栓形成,血栓下斑块结构可识别(图6C、图6D)。可能的OCT-斑块侵蚀(图6E、图6F):纤维帽完整,罪犯病变无血栓形成,管腔表面不规则;病变处伴血栓形成,血栓处斑块结构不可识别,血栓近端或远端无浅表脂质和钙化。(3)钙化结节:结节样钙化突出到管腔内,伴纤维帽破裂,可伴血栓形成。主要特征为结节样突出,浅表钙化,病变近端或远端常可见严重钙化(图6G、图6H)。
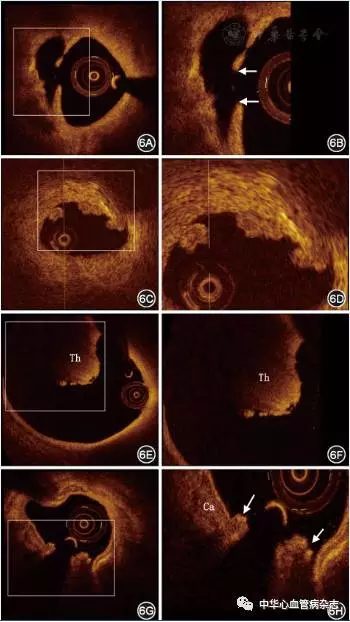
图6 OCT对急性冠状动脉综合征罪犯病变的识别[6A、6B:斑块破裂,脂质斑块的纤维帽连续性中断(箭头所示),伴空腔形成;6C、6D:明确的斑块侵蚀,纤维帽完整,未见斑块破裂,伴血栓形成;6E、6F:可能的斑块侵蚀,可见红色血栓(Th)突入管腔,邻近血栓处管壁无明显斑块形成,且管腔无明显狭窄;6G、6H:钙化结节,可见结节样钙化(Ca)突出到管腔内,呈火山喷发样改变,纤维帽破裂(箭头所示),伴有血栓形成;6B、6D、6F和6H分别为6A、6C、6E和6G中方框的放大图]
其他OCT可见的ACS罪犯病变包括自发性冠状动脉夹层和冠状动脉痉挛等。
2.OCT检测对ACS治疗策略及患者临床预后的影响:
OCT[12]及病理学[6]研究发现,ST段抬高型心肌梗死患者多由斑块破裂导致,罪犯病变管腔面积较小,且血栓负荷较大(以红色血栓为主),而非ST段抬高型ACS患者多由斑块侵蚀导致,罪犯病变处管腔面积较大,血栓负荷较小(以白色血栓为主)[16]。基于这些不同的病理及影像学特点,对临床上由斑块侵蚀导致的ACS患者,经溶栓或血栓抽吸后,造影显示无严重管腔狭窄(直径狭窄率<70%),且血液动力学稳定,血流达到TIMI 3级的患者,强化抗凝和抗血小板治疗可能是此类患者优先考虑的治疗策略[17]。当然,这一新的ACS治疗策略的安全性、有效性及长期临床预后仍有待于大样本前瞻性研究的证实。
回顾性研究发现,与斑块侵蚀相比,斑块破裂导致的ACS在PCI术后即刻出现"无复流"现象更为常见,但远期支架内膜覆盖二者无显著差别[18,19]。近期一项前瞻性研究表明,斑块破裂导致的ACS患者,3年主要不良心血管事件发生率更高(39.0%比14.0%,P=0.001),且斑块破裂是主要不良心血管事件的独立预测因子[20]。因此,可考虑将OCT检测的ACS罪犯病变类型纳入ACS患者危险分层,以更好地评估患者的远期预后。
(三)优化和指导PCI
术前OCT检测可以对预处理的病变进行精确评估,帮助术者选择合适的支架以及支架释放位置。同时,OCT可以提供参考血管的管腔及直径大小,有利于术者选择合适的支架长度和直径。根据参考血管的大小选择安全的后扩张球囊,以预防膨胀不全。此外,PCI术前进行OCT成像可评价斑块形态,预测患者PCI术后的疗效[21,22]。PCI术后行OCT检测可对支架膨胀、支架贴壁、支架内组织脱垂、支架边缘夹层以及支架内血栓等情况进行准确评估,为术者提供更多有用的解剖学信息,帮助术者优化PCI策略。
1.评价支架置入术后的即刻效果:
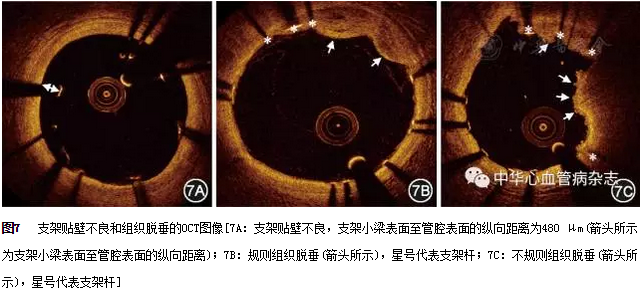
目前,OCT已被广泛用于评价支架置入术后情况。其影像特征如下:(1)即刻支架膨胀情况。在OCT图像中,支架膨胀情况采用膨胀率来评价,其公式为:支架膨胀率(%)=最小支架面积/平均参考管腔面积×100%。通常将90%作为评价支架膨胀不良的界值。一般来说,钙化病变和斑块负荷较重的偏心性纤维病变易出现支架膨胀不良。因此,对于这些病变应进行充分的预处理,如纤维偏心斑块应进行充分预扩张,严重钙化病变应进行旋磨或球囊切割术。PCI术后,OCT发现支架膨胀不良应积极处理。目前推荐采用非顺应性球囊进行高压后扩张支架,后扩张后应再次行OCT检查,以确定扩张效果。(2)即刻支架贴壁情况。在OCT图像上,支架贴壁不良是指支架小梁表面至管腔表面的纵向距离大于支架小梁厚度(如果支架小梁上有聚合物,也应包含在内),当支架与血管壁之间的距离大于"支架杆厚度+聚合物厚度+10μm",则定义为支架显著贴壁不良(图7A)。当小于或等于这一距离时,可认为支架小梁贴壁良好。(3)组织脱垂。在OCT图像上,组织脱垂的定义是支架置入后,组织投影处于支架小梁之间的管腔中(图7B、图7C)。组织脱垂按成分不同,可分为斑块脱垂和血栓脱垂。斑块脱垂通常表面光滑且无明显的信号衰减,而血栓脱垂通常表面不规则并伴有强衰减。目前的研究表明,表面不规则的组织脱垂与临床预后相关[23]。(4)支架边缘夹层。支架置入术后易导致血管壁的损伤,以夹层最为常见,易发生在支架边缘。支架置入术后出现血管夹层,对于夹层累及血管中膜,甚至出现血管壁内血肿或血管破裂者,应立即置入支架。应尽量从OCT显示的冠状动脉夹层远端正常处覆盖内膜撕裂片,以维持管腔,防止夹层扩展或血肿压闭管腔。(5)即刻支架内血栓。在OCT图像上,支架内血栓的定义是支架置入术后即刻出现的突入管腔内的不规则团块。前文中有关红色和白色血栓的OCT图像特点仍适用于支架内血栓。
2.PCI术后随访
支架失败是影响PCI术后患者远期预后的重要因素。OCT可准确评估支架失败的原因,故在PCI术后随访中推荐使用OCT。
在OCT图像上,支架内再狭窄是指支架新生内膜面积超过支架面积的50%。对于厚度>100 μm的支架新生内膜,按OCT图像特征可分为以下3类[24,25,26]:(1)均质性:高反射且信号相对均匀,无局部信号衰减;(2)异质性:低反射且信号不均匀,有局部信号的强衰减;(3)分层:向心性、双层或多层的光学信号,近腔侧通常为高反射信号,远腔侧通常为低反射信号。
晚期和极晚期支架内血栓是冠状动脉支架置入术后严重且致命的并发症。支架内膜覆盖不全、支架贴壁不良、支架内新生动脉粥样硬化斑块破裂等因素与支架内晚期血栓形成相关。
多项临床研究显示,OCT测量与组织覆盖物的组织学测量之间有高度的相关性[27,28]。在OCT图像上,支架小梁覆盖定义为可识别支架小梁上方组织;支架小梁未覆盖定义为支架小梁上方未出现组织覆盖。
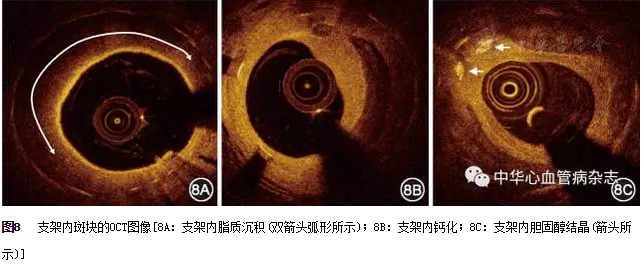
在OCT图像上,支架内新生动脉粥样硬化斑块表现为支架内增生的内膜高信号后有明显的信号衰减,并且边界模糊,提示脂质沉积(图8A)。其他OCT斑块特征也可见于支架内,如钙化(图8B)和胆固醇结晶(图8C)等。支架内新生动脉粥样硬化斑块是导致晚期支架失败的重要原因。
五、OCT的应用前景
(一)OCT在左主干及分叉病变中的应用
新一代FD-OCT能够快速安全地完成对左主干病变(除冠状动脉开口部病变)的扫描,在判断病变类型、评价管腔大小及支架置入后贴壁不良、边缘夹层及组织脱垂等方面,效果明显优于IVUS。但值得注意的是,由于受到OCT扫描深度的限制,不推荐OCT在左主干病变中常规应用。
分叉病变是冠状动脉支架置入失败率较高的复杂病变之一,术前行OCT检查可准确测量主支及分支开口狭窄程度、病变长度、斑块分布及性质[29,30],有助于术者选择合适的介入器械及分支支架治疗策略(单支架或多支架技术,或者是否需要保护分支血管)。新一代OCT系统的实时三维成像功能还可以提供血管的空间分布和结构,特别是对分叉开口的显示更为清楚[31]。研究表明3D-OCT指导分叉病变支架置入具有可行性,并且可减少支架贴壁不良的发生[32]。因此,在临床指导分叉病变治疗时,可考虑应用OCT。
(二)OCT在钙化病变中的应用
病理对照研究显示,OCT检测钙化病变的敏感度(95%~96%)和特异度(97%)很高。术前钙化病变的准确检测对选择再血管化方式至关重要。当OCT发现严重的环形钙化时,应避免直接置入支架,推荐优先考虑采用预扩张或试验性扩张的策略,在短的钙化环中可使用球囊切割或冠状动脉内旋磨术。
(三)OCT在生物可吸收支架中的应用
生物可吸收支架开启了新型支架时代。近期发表的ABSORB China研究表明[33],生物可吸收支架在临床安全和有效性方面不劣于金属药物洗脱支架[29]。OCT能够更精准地评价动脉粥样硬化斑块、支架组织贴壁情况和支架表面新生内膜覆盖等[34]。同时,对于支架的术后即刻及随访数据的重复性高,且不受分析方法或应用软件差异的影响。以上OCT成像技术特点使得其在可吸收支架领域的应用优势进一步提高。最新一代ILUMEIN OPTIS系统扫描速度更快,能够精确地进行术前病变准备。此外,联合腔内影像学技术和实时三维血管重建技术能够准确评价可吸收支架与边支血管的解剖位置,从而优化PCI过程。
1.指导可吸收支架置入:
目前的生物可吸收支架杆平均厚度较大(114~228 μm),且与金属支架相比,生物可吸收材料更加坚硬,可塑性差。可吸收支架置入术前对病变应做好充分的准备,比如对严重狭窄病变做精准的预扩张。同时,准确测量血管直径和病变特征,以选择合适大小的可吸收支架。因此,与IVUS相比,对于选择大小准确的支架和指导PCI过程,OCT是极为必要的影像学手段。
2.对可吸收支架的随访评价:
与其他影像学技术相比,OCT对于支架内新生内膜覆盖情况的评价有独特的优势。因此,可以应用OCT评价可吸收支架的支架内膜修复和支架杆远期降解。另外,OCT能够清楚显示可降解支架外形和置入后支架杆最终降解影像。
基于OCT在新型可吸收支架领域的巨大优势,目前推荐在生物可吸收支架置入及术后随访过程中应用OCT。
六、结论
综上所述,OCT可准确评估冠状动脉粥样硬化斑块并指导PCI,在支架随访中发挥着越来越重要的作用。在中国专家建议下规范化应用OCT,将有助于建立中国冠心病患者OCT临床研究数据库和循证医学证据,进而精准指导我国冠心病的诊疗过程。
参考文献略
转载自:《中华心血管病杂志》
编辑:Amy
- 基层心血管病综合管理实践指南2020
- ESC中文袖珍指南:高血压(2013年版)-临床指南..
- 新型口服抗凝药物在非瓣膜病心房颤动治疗的中国专家..
- 中国他汀安全性评价专家共识重点解析
- 2014AHA/ACC心脏瓣膜病管理指南推荐要点
- 2014年AHA/ACC 心脏瓣膜病患者管理指南
- 家庭血压监测中国专家共识
- 非二氢吡啶类钙拮抗剂在心血管疾病中应用的专家建议..
- 2015年先天性心脏病相关性肺动脉高压诊治中国专家共识..
- 指导规范 | 中国心房颤动患者卒中防治
- 【卵圆孔未闭中国专家建议】四成人有卵圆孔未闭,大..
- 室性心律失常最新指南解读
- 最新血脂领域指南与临床试验解读
- 解读 AHA/ACC/HRS 最新心房颤动治疗指南
- 欧版 | 2015急性心衰院前和院内管理指南
- 指南 | 中国缺血性脑卒中血脂管理指导规范..
- 【中国更新STEMI指南】建立区域救治网络,不建议急诊..
- 经导管肺动脉瓣置换医疗机构和操作人员需求专家共识..
- 他汀临床应用指南及副作用
- 强化他汀治疗,预防卒中复发——《中国缺血性脑卒中..





 京公网安备 11010102002968号
京公网安备 11010102002968号