张波教授:从斑块逆转看超高危ASCVD患者强化降脂策略
发布于:2020-12-16 17:38

作者:张波 大连医科大学附属第一医院
近几年,各大国际指南逐步明确了“超高危动脉粥样硬化性心血管疾病(ASCVD)”的概念,并对低密度脂蛋白胆固醇(LDL-C)的靶目标提出了新的标准。鉴于我国ASCVD发病率和死亡率呈持续升高趋势,且LDL-C知晓率、达标率均处于较低水平,新标准对于我国ASCVD患者的降脂管理提出了较高要求。
斑块逆转是ASCVD治疗的重要目标,LDL-C水平则是降脂治疗的首要干预靶点。越来越多证据表明,强化降低LDL-C,可以稳定甚至是逆转斑块,进而降低ASCVD患者的心血管不良事件风险,提升患者获益。
本文将基于近几年最新循证证据,结合新指南/共识的更新意见,就ASCVD患者的强化降脂策略进行阐述,并从斑块逆转的角度谈谈,强化降脂对于超高危ASCVD患者的临床意义。供各位读者交流、讨论。
“超高危ASCVD”定义逐步明确
降脂“1450”时代已然来临
近年来,全球各大指南对于ASCVD的危险分层不断细化,对LDL-C标准亦逐年降低。《2017美国临床内分泌协会/美国内分泌学会(AACE/ACE)血脂管理指南》在“极高危”危险分层之上添加“极端高危”分层。《2018美国心脏病学会/美国心脏协会(AHA/ACC)胆固醇管理指南》从ASCVD中分离出“极高风险ASCVD”。《2019欧洲心脏病学学会/欧洲动脉粥样硬化学会(ESC/EAS)血脂异常管理指南》对于“极高危ASCVD”给出了明确定义,并对各风险分层患者推荐了较以往指南均更低的降脂治疗目标值。对极高危患者的LDL-C水平,相对基线降低≥50%且LDL-C<55 mg/dl。
多国血脂指南基于充分循证依据将LDL-C目标值不断降低,我国作为血脂异常大国,于2019年发布《中国胆固醇教育计划(CCEP)血脂异常防治专家建议》,及时提出“超高危人群”概念,并将该部分患者的LDL-C目标值定为<1.4 mmol/L(55 mg/dl)或较基线水平降低幅度≥50%。2020年发布的《超高危ASCVD患者血脂管理中国专家共识》进一步将这一标准改为“LDL-C目标值<1.4 mmol/L且降幅≥50%”。
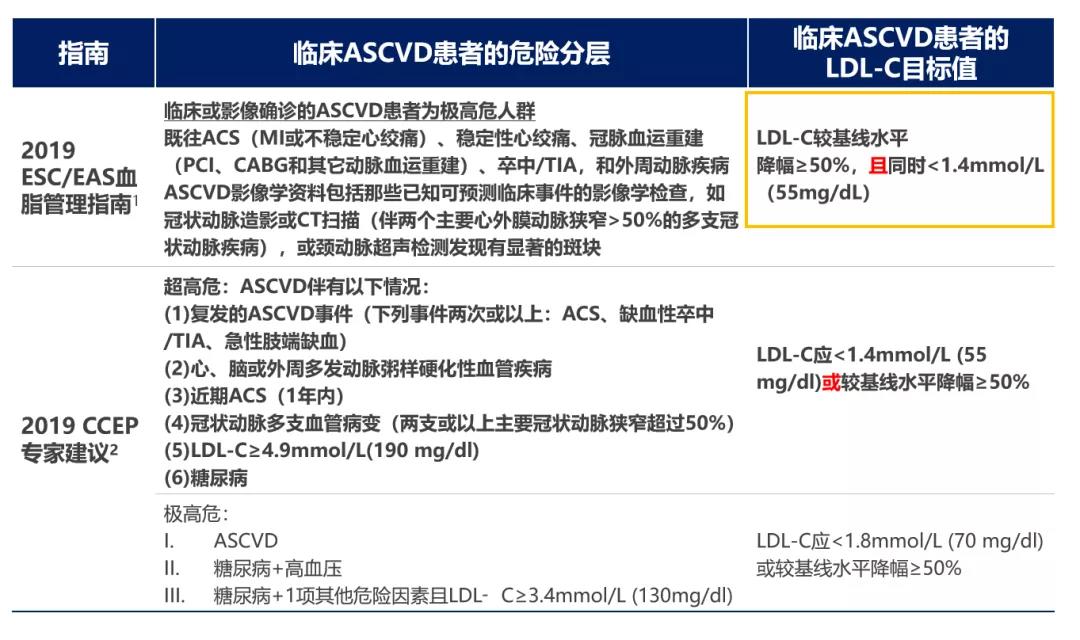
图1 各大指南均提出了更低LDL-C目标值
纵览各国指南变迁可发现,所谓“超高危ASCVD”即指的是具备“频、多、杂、近期”等特征的ASCVD患者。而在降脂目标上,现如今,我国血脂管理已正式开启“LDL-C靶目标值<1.4mmol/L”的新篇章,超高危ASCVD患者的LDL-C目标值正式进入“1450”时代。
以强化降脂策略
力促超高危ASCVD患者双达标
01 强化降脂,降低MACE风险
早期研究证实,降胆固醇的临床获益取决于LDL-C降幅,与降胆固醇的措施无关。一项共纳入25项他汀研究的荟萃分析结果显示,LDL-C每下降1 mmol/L,则MACE风险减少23%。其中一级预防中,LDL-C每下降1 mmol/L,MACE风险下降30%。二级预防中,LDL-C每下降1 mmol/L,MACE风险下降21%。ASCVD风险随LDL-C水平的下降而降低,但临床实践中具体应将LDL-C降低至何种标准?近年来多项研究进行了探索。
IMPROVE-IT研究结果显示,LDL-C从69 mg/dl降至53.2 mg/dl可进一步降低CVD事件。预设亚组结果显示,ACS患者LDL-C水平<30 mg/dl,心血管获益更大,且安全性良好。
FOURIER研究中,PSCK9抑制剂依洛尤单抗使得患者的LDL-C平均降低59%,LDL-C水平从92 mg/dl降至30 mg/dl,平均降幅绝对值为56 mg/dl。LDL-C的下降使得主要终点相对风险降低15%,关键次要终点相对风险降低20%。
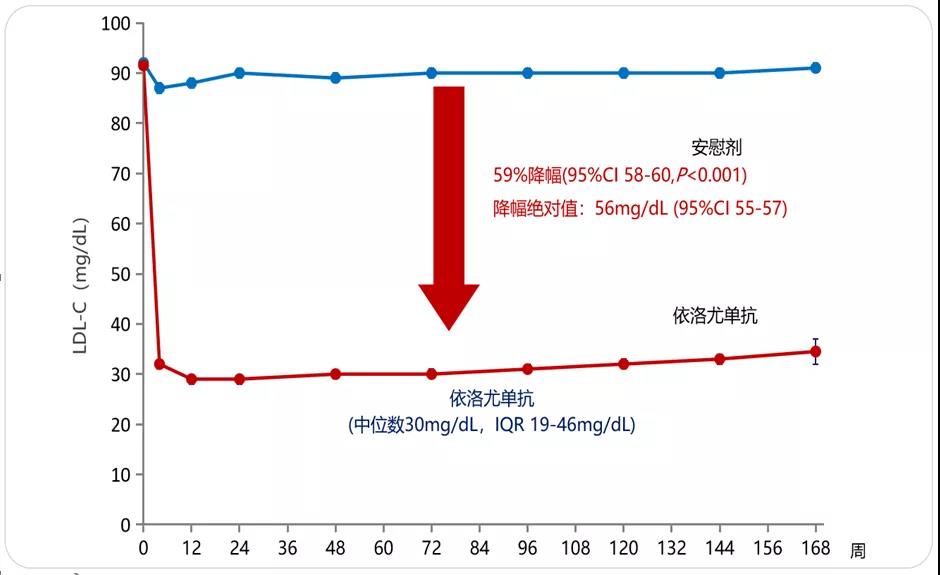
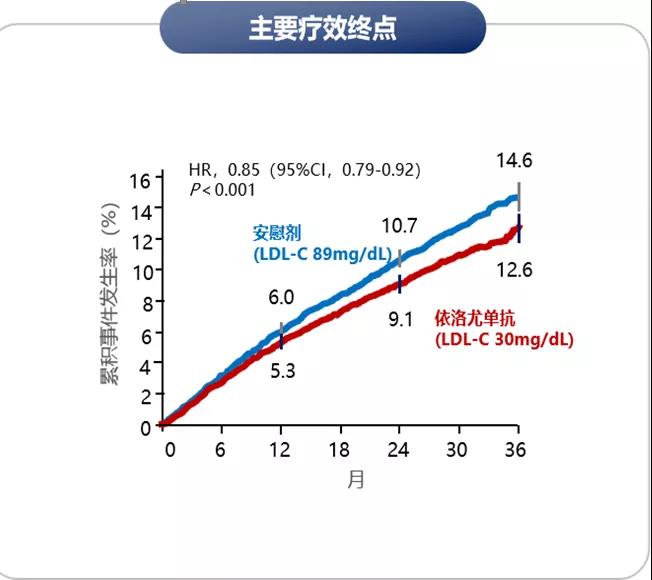
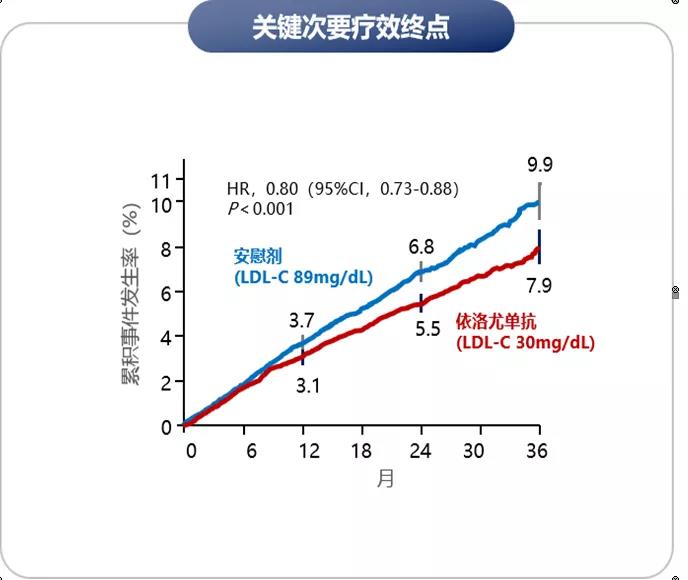
图2 FOURIER研究结果
ODYSSEY OUTCOMES研究结果显示,PSCK9抑制剂组将患者的LDL-C降至53.3 mg/dl,较安慰剂组降幅达到54.7%,MACE风险和全因死亡率均下降15%。
多项荟萃分析亦证实,经他汀治疗后,与LDL-C水平75~100 mg/dl的患者相比,LDL-C < 50 mg/dl的患者的主要心血管事件进一步降低。在较低LDL-C基线时进行进一步降脂治疗,仍可获得心血管事件获益。
众多循证证据提示,LDL-C降低幅度越大,ASCVD患者获益越多。各大指南将LDL-C的目标值定为<1.4 mmol/L(55 mg/dl)是证据充分、切实可行的。未来随着研究进展,LDL-C甚至还有可能向更低的目标值迈进,或能带来进一步获益。
02 强化降脂,促使斑块稳定/逆转
从病理生理学层面看,动脉斑块的稳定甚至逆转,是ASCVD的终极治疗目标。越来越多证据显示,积极降脂治疗,降低LDL-C水平,可有效促进斑块稳定,甚至实现逆转。
早期研究显示,经他汀治疗LDL-C降至80 mg/dl以下,可延缓甚至逆转动脉粥样硬化进展。近年来,PRECISE-IVUS研究证实,相较于单用他汀,他汀加用依折麦布可以更显著降低LDL-C水平(1.64 mmol/L),并且可以更为有效地逆转冠状动脉斑块,发生逆转的患者比率高达78%。
依洛尤单抗可带来强效的LDL-C降低,其在斑块逆转方面的表现也得到高质量临床研究证实。GLAGOV研究纳入197个中心的968例症状性冠状动脉疾病(CAD)患者,采用血管内超声评估斑块进展或消退情况。结果显示,依洛尤单抗组相对安慰剂组有更多患者发生斑块逆转(64% vs. 47%)。当LDL-C<60 mg/dl时,全部动脉斑块均开始逆转,斑块体积呈减小趋势。
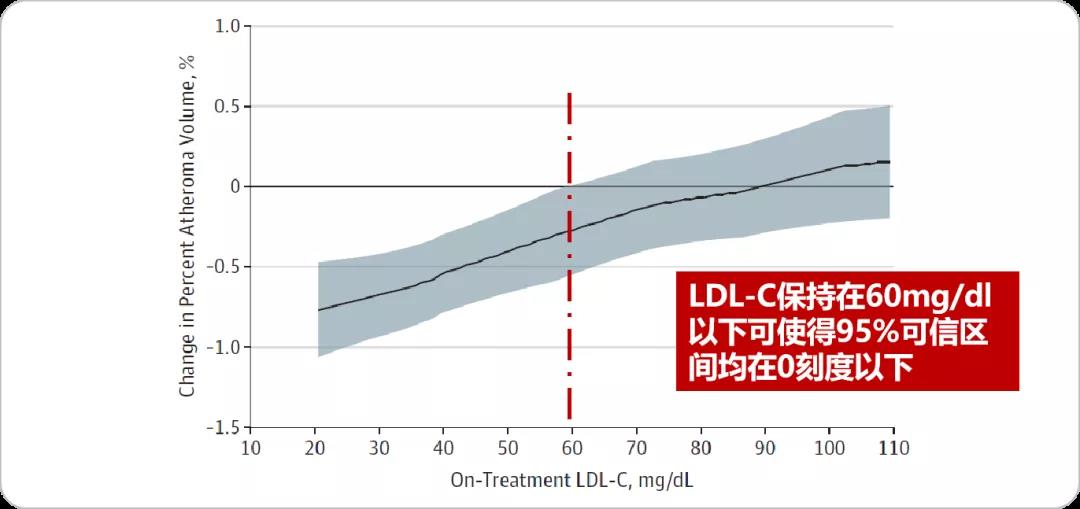
图3 GLAGOV研究显示,当LDL-C <60mg/dl时,全部的动脉斑块开始逆转
积极降脂治疗,不仅可使得斑块消退,还能稳定不稳定斑块、逆转血管壁正向重构。一项前瞻性注册研究共纳入308例经过他汀治疗6个月以上的CAD受试者,并且在PCI术前给予FD-OCT对犯罪血管进行检查。结果显示,LDL-C<50 mg/dl组受试者的斑块纤维帽更厚,且薄帽的粥样斑块(TCFA)占比更少。与LDL-C水平50~70 mg/dl相比,LDL-C < 50 mg/dl的冠脉斑块更稳定。
03 降幅≥50%,斑块逆转的开始
REVERSAL研究同时对LDL-C的降幅和斑块体积进行了线性回归分析,结果显示,当LDL-C降幅超过50%时,不同他汀治疗组患者的斑块均保持稳定并出现逆转,提示LDL-C降幅超过50%是逆转斑块的开始。
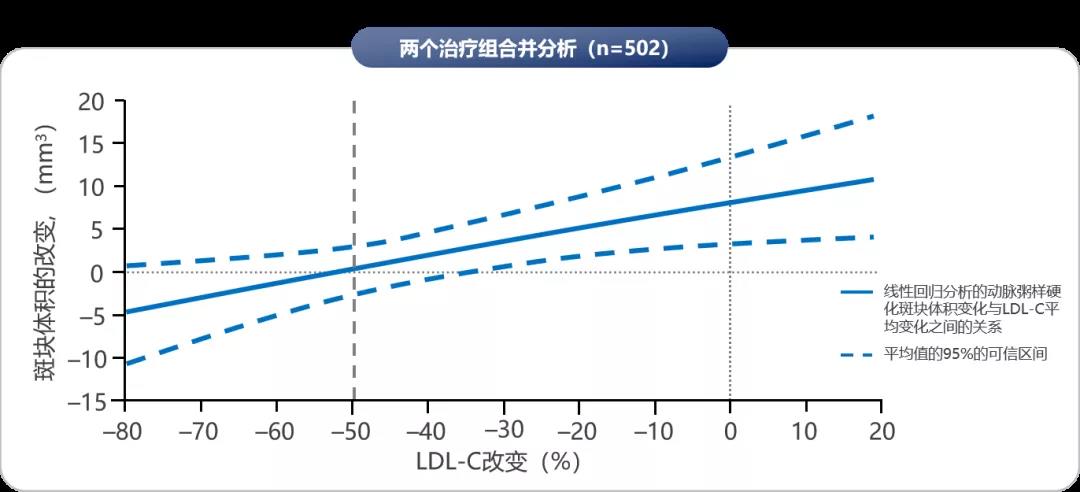
图4 LDL-C降幅超过50%,逆转斑块的开始
一项荟萃分析共纳入27项临床研究,运用血管内超声探索LDL-C水平与冠状动脉斑块体积的关系。结果显示,动脉粥样硬化斑块的体积与LDL-C水平下降呈线性关系。且不论LDL-C的目标值是多少,降幅≥50%都是足够的。
一项纳入TNT、IDEAL以及SPARCL患者的研究分析中,基于LDL-C是否≤70 mg/dl和LDL-C降幅是否<50%,将所有患者分为四个亚组。结果显示,在5032例LDL-C≤70mg/dl的受试者中,LDL-C降幅<50%的受试者与LDL-C降幅≥50%的受试者相比,主要终点风险增加了51% ,死亡风险增加了37%,卒中风险增加了107%。这一结果再次印证,LDL-C降幅≥50%对于降低ASCVD患者风险,提升获益具有重要意义。
综上所述,从目前的循证证据来看,要求超高危ASCVD患者实现“LDL-C目标值<1.4 mmol/L”和“降幅≥50%”双达标可以保证患者的心血管获益,并促进斑块稳定和逆转。
极低LDL-C水平安全性良好
强化降脂同时安全达标
极低LDL-C水平通常是指LDL-C<1.0 mmol/L(40 mg/dl)的患者,对于极低LDL-C水平与低或正常LDL-C水平的不良事件发生率之间是否存在相关性,临床曾有过担忧,但多项研究证实了极低LDL-C的安全性。
IMPROVE-IT研究、ODYSSEY研究显示,长期极低LDL-C水平不增加临床不良事件;FOURIER研究显示,依洛尤单抗治疗组与安慰剂组在神经认知事件、白内障和新发糖尿病等不良事件发生率方面均无显著性差异。亚洲人群亚组分析结果显示,联合依洛尤单抗后,亚洲人群与其他人群相比,安全性结果相似;一项荟萃研究纳入了IMPROVE-IT研究、FOURIER研究和REVEAL研究中共计5万余例患者,安全性分析显示,与对照组相比,实验组的患者临床不良事件发生率没有明显增加,两组之间差异无统计学意义。
结语
近期更新的国内外降脂领域新指南/共识均强调了超高危ASCVD的概念,强化降脂治疗目标值的重要性,并提出了新的降脂治疗标准。对于超高危人群,要求“LDL-C目标值<1.4 mmol/L”且“降幅≥50%”。在具体降脂治疗原则上,指南推荐以他汀类药物为基础用药,对他汀类药物不能达标的患者,可以加用依折麦布或者PCSK9抑制剂。
新的标准,新的策略,临床医生需深刻理解指南更新要点,在临床中为超高危ASCVD患者制定个体化强化降脂策略,使每一位患者都能得到最好的治疗。
参考文献:
1. Jellinger PS, et al. Endocr Pract. 2017 Apr;23(Suppl 2):1-87.
2. Grundy SM, et al. J Am Coll Cardiol. 2018 Nov 8. pii: S0735-1097(18)39034-X.
3. Mach F, et al. Eur Heart J. 2019. doi:10.1093/eurheartj/ehz455. Epub ahead of print.
4. 中华内科杂志, 2020,59(1):18-22.
5. 中华医学会心血管病学分会动脉粥样硬化与冠心病学组. 中华心血管病杂志. 2020; 48(4): 280-286.
6. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce. European Heart Journal 2019 -doi: 10. 1093/ eurheartj /ehz455.
7. Robinson JG, et al. J Am Coll Cardiol. 2016 Dec 6;68(22):2412-2421.
8. Catapano AL, et al. Eur Heart J. 2016 Oct 14;37(39):2999-3058.
9. Cannon CP, et al. N Engl J Med. 2015; 372(25):2387-97.
10. Sabatine MS et al. Am Heart J 2016;173:94-101.
11. Schwartz GG, et al. N Engl J Med. 2018 Nov 29; 379(22):2097-2107.
12. Kataoka Y. Atherosclerosis. 2015 Oct;242(2):490-5.





 京公网安备 11010102002968号
京公网安备 11010102002968号