围手术期抗凝和抗血小板治疗的桥接
发布于:2013-07-16 18:06
文 / 聂绍平 王晓 首都医科大学附属北京安贞医院
聂绍平,首都医科大学附属北京安贞医院急诊危重症中心主任,医学博士,主任医师,教授,博士研究生导师,卫生部首批冠心病介入培训导师。主要从事冠心病临床与研究工作。擅长冠心病介入治疗,个人累计完成经皮冠状动脉介入治疗(支架术)达7000余例,并连续四年超过1200例,为国内个人完成例数最多的中青年专家之一。在国内外发表论文150余篇,主编学术专著3部,参编学术专著20余部。
对于长期接受口服抗凝药(如维生素A 受体拮抗剂,VK As)或抗血小板治疗而需要外科手术或侵入治疗的患者,围手术期抗栓策略的选择是临床实践中的一大难题。术前停用抗栓药物增加血栓栓塞风险,而围手术期持续应用术后出血风险明显增加。对于接受口服抗凝药的患者,应用短效抗凝药普通肝素(UFH)或低分子肝素(LMWH)进行桥接成为理想的选择。另一方面,对于长期服用抗血小板药物的急性冠脉综合征(ACS)或冠脉支架置入术后患者,围手术期桥接方案尚无一致性意见。为此,本文旨在总结围手术期抗凝和抗血小板桥接的临床试验证据和共识意见,为临床医师提供参考。
一、抗凝治疗的桥接
1. 桥接抗凝的提出
动脉或静脉血栓栓塞(VTE)是患者住院的主要原因之一,其致死和致残率极高。心房颤动(AF)和人工心脏瓣膜(MHV)是导致动脉血栓栓塞最常见的原因。国外研究显示,瓣膜血栓死亡率为15%,而栓塞性脑卒中导致主要神经损伤和死亡的发生率高达70%。据估计,在美国的住院患者当中,每年有近60万VTE 事件发生。相关资料显示,VTE 总的1 年生存率为63.6%,深静脉血栓形成和肺栓塞分别为85.4% 和47.7%。口服抗凝药物VK As(如华法林)的问世,给大量高危血栓栓塞风险患者带来了福音,现已广泛应用于血栓栓塞的一级和二级预防。然而,此类患者若接受手术治疗,临床医师往往进退两难。术前停用VK As 增加血栓栓塞风险,围手术期持续应用则出血风险大大增加。在VK As 停用的10~12 天内,INR 未达标,应用短效抗凝药UFH 或LMWH 进行桥接逐渐被临床医师所接受,尽管尚缺乏大规模循证医学证据,桥接抗凝(尤其是LMWH)在临床实践中的应用已颇为广泛。
2. 桥接抗凝的临床试验证据
尽管桥接抗凝治疗逐渐成为围手术期的“常规”,但不同人群、不同手术的风险- 获益比仍不尽相同。近年来,大量临床研究比较了桥接与非桥接抗凝治疗的临床获益,由于入选人群、试验设计差别较大,因而结果并不统一,桥接抗凝能否真正获益仍存在较大争议。
ACTION 研究是第一个前瞻性评估短期停用双香豆素类药物风险的临床研究。共有1293 人次术前停用华法林,最常见的抗凝指征是AF(n=550),VTE(n=144)和MHV(n=132),最常见的操作是结肠镜、口腔或眼科手术。结果显示,桥接组(8.4%)血栓栓塞和出血发生率分别为0 和13%,非桥接组(91.6%)分别为0.6% 和0.8%。结果表明,桥接治疗虽能降低血栓栓塞风险,但有增加潜在出血风险的趋势。
最近,许多临床试验分析了桥接抗凝在接受器械置入(如心脏起搏器,PM 或置入式心脏复律除颤器,ICD)患者中的效果,结果并不尽如人意,对以往的“常规”提出了挑战。Tischenko 等比较了持续华法林治疗与LMWH 桥接治疗在接受器械置入患者中的出血风险,发现LMWH 组局部血肿(23.7% vs 7.7%,P = 0.012)和囊袋修补(7.9% vs 0.9%,P = 0.046)发生率明显高于华法林组。Robinson 等研究同样证实,对于接受PM 或ICD 的患者,术后LMWH 桥接治疗显著增加伤口出血发生率(23% vs 8%,P = 0.01)。新近,Tolosana 等发表在《欧洲心脏病学杂志》上的研究是第一个比较桥接抗凝与华法林持续治疗的随机临床试验。结果显示,两组血肿和血栓栓塞发生率均无显著性差异。由此可以看出,桥接抗凝对行PM 或ICD 置入的患者并无优势,主要体现在:①增加器械囊袋血肿风险;②存在潜在正常凝血期伴随动脉血栓栓塞风险;③与华法林相比,技术繁琐且费用更高。
由于以上研究多为非随机对照研究,评价的人群亦不尽相同,因此目前指南推荐也仅限于专家共识。大型随机、双盲、平行对照研究BRIDGE(NHLBI 资助)、PERIOP 2(CIHR 资助)已经启动,相信随着试验结果的公布,会为桥接抗凝的临床价值提供更可靠的证据。
3. 桥接抗凝的风险评估
对于长期口服华法林的患者,术前有效合理的风险评估必不可少。抗凝药物的中断使患者暴露于高血栓栓塞风险之中,导致灾难性的后果,如栓塞性脑卒中、人工瓣膜血栓形成以及支架内血栓形成;尽管围手术期相关出血可以治愈,但危害性远超过人们想象,而且术后出血推迟抗凝药应用时间,反而增加患者血栓栓塞风险。因此,应时刻保持清醒的头脑,积极预防风险。
首先,根据手术类型评估出血风险,决定是否需要停用抗凝药物;其次,根据抗凝指征及合并症评估血栓栓塞风险,在抗凝药物停用的情况下,决定是否需要桥接抗凝,值得注意的是,可靠的术后止血不可或缺,因其会影响术后口服抗凝药的给药时间;最后,术后(尤其是1~2 周内),有必要对血栓栓塞和出血风险保持高度警觉,谨防不良事件发生。
最新2012 年ACCP 指南指出,对于较大外科手术或侵入操作(如颅脑手术或ICD 置入),推荐停用VK As 以降低出血风险;对于接受小型手术或侵入操作(如白内障手术或牙科、皮肤科)的患者,推荐不停用VK As,但要达到有效止血(2C)。在VK As 停用期间,对于血栓栓塞高风险的MHV、AF 或VTE 患者,推荐桥接抗凝优于无桥接治疗(2C);对于中等风险患者,桥接与无桥接策略的选择需要综合评估患者个体与手术相关因素(无推荐级别);对于低风险患者,推荐无桥接治疗优于桥接抗凝(2C)。
4. 短效抗凝药物的选择——LMWH 还是UFH ?
治疗剂量的UFH 曾经是手术医师首选的桥接方案,然而,由于静脉用药的不便以及门诊手术量的增多,近年来其应用率逐渐下降。LMWH 不仅可以院外给药而且不需实验室监测,逐渐受到临床医师的青睐。国外资料显示,迄今有超过4000 例患者参与了桥接抗凝的研究,约72% 接受了治疗剂量的LMWH,20% 接受了低剂量的LMWH,8%接受了治疗剂量的UFH。
Amorosi 等的前瞻性队列研究显示,与院内静脉(IV)UFH 给药相比,家中自行皮下注射(SC)依诺肝素节省围手术期抗栓相关费用约1344 美元~3733 美元。Caprini等研究显示,LMWH(n=241)与UFH(n=72)桥接组的住院时间分别为4.0 天和6.1 天,差异具有统计学意义(P<0.01)。REGIMEN 注册研究是首个大规模多中心前瞻性研究,旨在比较LMWH 和UFH 桥接抗凝术后30 天的不良事件发生率。结果显示,两组间总不良事件(P =0.82)、主要出血(P =0.17)、次要出血(P =0.23)发生率均无显著性差异。由此看出,LMWH 桥接可以缩短住院时间,降低总费用,而且安全可行,并不增加血栓栓塞和出血风险。2008 ACCP 指南也指出,从费用考虑,桥接抗凝推荐门诊SC LMWH 优于住院IV UFH(1C)。
5. 选择最佳的桥接方案
围手术期桥接方案的选择不仅与人群风险、抗凝药物密切相关,而且还应考虑剂量、给药及撤药时机等多方面因素。尽管许多临床研究证实了其可行性,但在入选人群、研究设计及抗凝药物的选择上有较大差异。因此,迫切需要建立桥接抗凝的统一标准。
2012 年ACCP 指南指出,对于需要桥接抗凝的患者,建议术前大约5 天停用VK As 以消除大部分抗凝效应,从而使出血风险降到最低(1B);在有效止血的前提下,建议术后12~24h(手术当晚或次晨)恢复VK As(2C)。常用的肠外抗凝药UFH 和LMWH 用于桥接的半衰期分别为45min和4~5h,完全消除分别需要4h 和20~25h。O'Donnell 等[12]首次评估了术前标准剂量LMWH 的残余抗Xa 水平。结果显示,79(99%)名患者术前抗Xa ≥ 0.1U/mL,末次给药时间和手术时间间隔越短,其水平越高(P =0.001)。因此,根据2008 年和2012 年ACCP 指南,对于接受治疗剂量IV UFH 或SC LMWH 的患者,围手术期撤药和给药时机见表1。

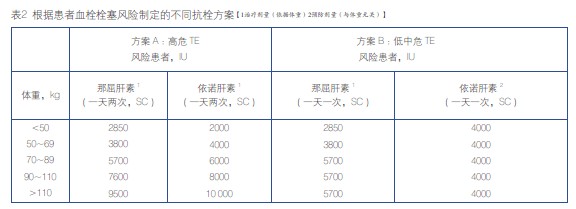
2009 年,Pengo 等根据患者的血栓栓塞风险采用不同的桥接方案,旨在评估这种个体化治疗的有效性和安全性。主要分为:方案A(LMWH 一天两次,应用于高血栓栓塞风险人群),方案B(LMWH 一天一次,应用于低中危血栓栓塞风险人群)(表2)。结果显示,总血栓栓塞发生率为0.4%,总出血发生率为1.5%,A 组出血事件发生率显著高于B 组(2.7% vs 0.7%,P =0.011)。结果表明,这种“量体裁衣”式的桥接方案对大多数人群是安全有效并可行的。为此,2008 ACCP 也对桥接方案做出了总结,可供临床参考。
2008 ACCP 桥接方案:
■ 术前5~6 天停用VK As
■ 术前4 或3 天应用LMWH
■ 术前末次LMWH 为½ 常规剂量
■ 术后1~2 天开始应用VK As
■ 术后1~2 天LMWH 应用预防剂量或不用
■ 术后2 天开始应用治疗剂量LMWH 直到INR 达标
二、抗血小板治疗的桥接
最新欧美指南均建议,ACS 和支架术后患者接受12 个月的双联抗血小板治疗。在此期间,10%~15% 的ACS 患者需要接受CABG;而在支架术后,5%~25% 的患者需要接受非心脏手术。围手术期应用抗血小板药物(主要是ADP 受体拮抗剂)可使出血风险增加约35%,而出血和输血显著增加死亡风险;术前停用则增加缺血事件风险约20%。由于缺少大规模的循证医学证据,因而在围手术期尚无行之有效的桥接方案。
1. 一般非心脏手术
原则上,与桥接抗凝相似,抗血小板治疗的桥接也要评估出血和血栓栓塞风险。2012 年ACCP 指南指出,对于接受小的牙科、皮肤或白内障手术的患者,建议围手术期继续应用阿司匹林(2C);对于高心血管事件风险患者,同样建议继续应用阿司匹林(2C);对于低心血管事件风险患者,建议术前7~10 天停用阿司匹林(2C)。ADP 受体拮抗剂术前是否停用应综合评价血栓(如近期支架置入)和出血风险(如手术类型)。对于冠脉支架术后接受双联抗血小板治疗的患者,建议推迟手术到金属裸支架(BMS)术后至少6 周,药物洗脱支架(DES)术后至少6 个月(1C);对于BMS 术后6 周内或DES 术后6 月内需要接受非心脏手术的患者,建议围手术期继续接受双联抗血小板治疗(2C)。对于术前停用阿司匹林和/ 或氯吡格雷的患者,在有效止血的前提下,应于术后约24 小时(次晨)恢复使用(2C)。
在临床实践中,绝大多数接受CABG 的患者均已使用一种甚至多种抗血小板药物,其中以阿司匹林+ 氯吡格雷的双联抗血小板治疗最为常见。在CABG 的围手术期正确地管理和使用抗血小板药物,对于减少围手术期缺血和出血事件具有重要意义。
大量研究证实,CABG 术前应用阿司匹林既可显著降低围手术期缺血性事件、心源性死亡及血栓栓塞事件的发生率,又有利于提高术后桥血管(大隐静脉)的通畅率。由于CABG 前持续应用阿司匹林的益处远远超过出血的风险,这一方案已被许多中心和指南采纳。2010 年欧洲心肌血运重建指南建议,CABG 术前无需停用阿司匹林,术后如无禁忌证也应给予小剂量阿司匹林,以改善静脉桥血管的远期通畅率。2011 年ACCF/AHA CABG 指南也建议,CABG 术前应用阿司匹林;若术前未应用,应于术后6 小时内应用并长期持续,以减少静脉桥血管闭塞和不良心血管事件。2012 年ACCP 指南同样推荐CABG 围手术期继续应用阿司匹林。
目前国内用于临床的ADP 受体拮抗剂主要为氯吡格雷。CURE 试验发现,CABG术前5 天内停用氯吡格雷不仅增加术后7 天内大出血,还是预测出血再探查术的独立危险因素。与氯吡格雷相比,普拉格雷的清除时间更长,作用也更强。2011 年ACCFAHA CABG 指南建议,对于择期CABG 患者,氯吡格雷和替格瑞洛应于CAB G 前5 天停用(I/B),普拉格雷应于CABG 前7 天停用(I/C)。而对于急诊CABG 患者,术前氯吡格雷和替格瑞洛应至少停用24 小时(I/B),以尽可能减少主要出血并发症。2012年ESC 有关STEMI 指南也建议,接受CABG 的稳定患者,术前氯吡格雷应至少停用5天,普拉格雷至少停用7 天;指南还强调,若术前血小板功能检测正常,早期亦可以行CABG 术。对于停用抗血小板药物后血栓栓塞风险极高的患者(如支架置入后第一周),建议在术前5 天开始停用氯吡格雷,改用短效、作用可逆的抗血小板药物(如替罗非班、依替巴肽),并于术前4h 停止输注。另外,2012 年ACCP 指南建议CABG前5 天停用氯吡格雷和普拉格雷(2C)。
与氯吡格雷和普拉格雷等药物不同的是,坎格瑞洛(cangrelor)为新型静脉抗血小板药物,可直接作用于P2Y12 血小板受体,快速、可逆地抑制ADP 诱导的血小板聚集,从而发挥抗血小板作用。2012 年JAMA 发表的一项研究显示,对于CABG 术前停用ADP 受体拮抗剂的患者,与安慰剂组相比,静脉应用坎格瑞洛进行过渡能实现持续的血小板抑制,而并不增加CABG 相关出血事件。因此,坎格瑞洛有望成为CABG围手术期桥接治疗的理想药物。
总之,桥接抗凝已为广大临床医师所接受,但具体的治疗方案仅限于专家共识,尚需大规模的临床研究加以证实。对于接受双联抗血小板治疗的患者,外科围手术期如何过渡成为亟待解决的实际问题。更重要的是,围手术期处理中需要在血栓栓塞和出血之间求得平衡。一个错误的判断,一次不当的操作均有可能导致严重并发症。因此,临床医师应时刻绷紧琴弦,谨慎评估血栓栓塞和出血风险,权衡利弊,采用个体化的桥接方案,使患者安全、平稳地度过手术期。(参考文献略)
来源: 医心评论





 京公网安备 11010102002968号
京公网安备 11010102002968号