《肾去交感神经导管射频消融治疗高血压病伴症状性房颤》临床试验设计原理
发布于:2014-03-03 10:52
编者按:CIT2014专题学术研讨会将开设五个心律失常专场,再次凸显了心脏冠脉介入治疗发展与心电生理和起搏领域之间的重要相关性。2014年3月21日(星期五)~2014年3月23日(星期日),锁定上海跨国采购会展中心二层208会议室,敬请期待精彩内容。下文特邀南京医科大学第一附属医院单其俊教授预先与您分享房颤治疗领域新技术——肾去交感神经导管射频消融治疗高血压病伴症状性房颤的相关内容。有关该主题演讲更多详情,请关注:2014年3月21日星期五11:36 AM 上海跨国采购会展中心二层208会议室。
文 / 单其俊 南京医科大学第一附属医院
单其俊 南京医科大学第一附属医院;心内科,主任医师,教授,医学博士,博士生导师,现任江苏省人民医院大内科副主任、心脏科第三病区主任,中华医学会心电生理和起搏分会第4届委员会委员,南京市临床电生理学会主任委员,美国心律协会(Heart Rhythm Society)会员,《中华心律失常学杂志》《中国心脏起搏与心电生理杂志》编委。
心房颤动(Atrial Fibrillation, AF)是临床上最常见的室上性心律失常,患病率为0.4%-1.0%,我国人口基数大,估计AF患者超过800万[1],AF的并发症如脑卒中、体循环栓塞、心力衰竭等具有很高致残率和致死率,严重影响国民身体健康,增加医疗经济负担。虽然国内外有很多关于AF临床和基础研究,但AF防治仍然是一个世界性难题。
AF治疗虽经过很多年努力,目前预防和治疗仍很不理想。AF治疗分为药物治疗和非药物治疗。药物治疗方面,传统的抗心律失常药物疗效不佳,由于心外不良反应和潜在的致心律失常作用而受到限制;心室率控制策略应用较广泛但抗凝药应用不足,抗凝的知晓率低,接受抗凝治疗的比例低,治疗中能应用指南推荐的有效剂量,达到有效目标(华法林,INR,=2.0~3.0)的比例更低,不能完全预防AF的卒中和栓塞发生。非药物治疗方法,AF心房导管消融近年来得到迅猛发展,目前有多种消融术式,包括节段性肺静脉隔离术、环肺静脉隔离术、心房线性消融、复杂碎裂电位消融和联合治疗等方法,但是心房导管消融虽然有不断更新专家共识,地位仍存在争议,其复发率高,长期随访的成功率低。2012年10月新英格兰杂志报道一个随机双盲多中心前瞻性临床注册(NCT00133211)研究,对比射频导管消融(CPVI,146例)和抗心律失常药物(148例)作为阵发性AF一线治疗优劣,2年随访结果射频导管消融与抗心律失常药物两组累计AF负荷没有明显差异(13% VS 19%)[2]。2012年11月JACC报道了德国汉堡中心202例长期持续性AF患者五年心房射频导管消融结果,持续性AF患者77%合并高血压,单次和多次手术成功率分别为20%和45%[3],同一期编者评述:长期持续性AF为电生理转移性肿瘤[4]。如果合并的高血压、肥胖等危险因素未很好控制,其复发率可高达75%[5], 心房内导管射频消融手术费用高,同时存在肺静脉狭窄、心房食管瘘、栓塞和心脏填塞等严重并发症风险。
AF本质是心房心肌病,结构上表现为由于左房压力增高、左房拉伸变薄扩大和心房肌纤维化、镜下心房肌纤维环死和排列紊乱及大量间质纤维化组织,电生理表现为大量低电压区、电传导速度减慢、有效不应期缩短和离散度增加,即心房结构与电重构。心房继发性的结构和电生理改变又有利于房颤的维持,形成一种恶性循环状态,最终使阵发性房颤发展成为持续性状态,即房颤导致房颤 (AF begets AF)。
已知AF独立危险因素包括:高血压、糖尿病、甲状腺功能亢进、结构性心脏病、阻塞性睡眠呼吸暂停、肥胖、老年化等。随着生活及居住条件改善,风湿性心脏瓣膜病的发病明显降低,高血压成为了AF最常见的危险因素,并使合并AF病人中风的危险性增加[6]。2007年欧洲高血压治疗指南指出:高血压是AF最重要危险因素,左室肥厚及左房扩大是新发AF独立的预测因子。中国AF住院病人调查显示AF患者半数伴有高血压。美国最近结束的一项长达35年的随访研究显示最初健康的中年男性,血压正常高限也是预测将来发生AF危险因素[7]。长期高血压可通过压力负荷和容量负荷的变化使左心室构型改变导致舒张功能受损,左心室舒张末期压力逐渐增高,使心房压力也逐渐增高,心房扩大和纤维化。研究表明左心房压力和扩大的程度与高血压的严重程度相关,左心房压力及大小是AF的重要预测因素。Kalifa[8]研究发现当左心房压力超过10cm水柱(H2O)时,肺静脉和左心房交界处就能成为AF发生和维持的关键“转子”。在Framingham研究[9]中,调整其它危险因素后,左房内径每增加5mm,发生AF的危险性就相应增加39%。我们中心自2008年9月至2009年2月共纳入106例初次行房颤心房导管消融的患者,分为阵发性房颤(Paro-AF)组(62例)和非阵发性房颤(Non-Paro-AF)组(44例),术前1天行食道超声检查测量左心房内径(LAD),术中通过房间隔穿刺测量左房压(LAP),消融前Non-Paro-AF 组LAP和LAD明显高于Paro-AF组(LAP:21.77mmHg VS 14.4mmHg,LAD:41.43mm VS36.15mm),并且Paro-AF组患者经短阵猝发刺激诱发AF3分钟后的LAP明显高于初始窦性心律时的LAP(18.30mmHg VS 13.33mmHg)。术后平均随访14个月,房颤复发患者消融前LAP及LAD明显高于未复发患者(LAP:23.56mmHg VS 14.82mmHg,LAD:41.50mm VS36.97mm)。多因素回归分析提示LAP和LAD为房颤消融术后复发的独立预测因素[10]。高血压病人多数伴有全身或局部肾素—血管紧张素—醛固酮系统(RAAS)激活,AngⅡ参与了心房结构重构、电重构及细胞缝隙连接重构触发AF。AngⅡ是一个强的促纤维化因子,引起间质纤维化,提供了AF的病理生理基质[11]。因此控制高血压,减缓高血压对心房基质损害,进而减少AF的发生及阵发性AF转为持续性AF可能有重要作用。
已知交感神经活性状态在原发性高血压的起病及长期维持过程中起着重要作用,同样对AF的发生有着重要影响。不仅动物实验发现肾上腺能激动剂(异丙肾上腺素和肾上腺素)可促进AF发生 [12,13],而且Oral等[14]在人体研究中发现注射异丙肾上腺素能使84%有阵发性AF病史的患者诱发持续性AF,并呈现剂量依赖性。近年来多项临床研究证实β-受体阻滞剂(美托洛尔、艾司洛尔等)可有效预防持续性AF复律后AF或房扑的复发[15,16]。本中心[17]回顾性分析了312例冠状动脉旁路移植 ( CABG) 术后房颤发生相关因素,结果发现术后1-3周AF的发生率为33. 01%(103/312),多元回归分析提示高龄、术后早期停用β受体阻滞剂、高血压、左房内径增大和AF病史是CABG术后发生AF的独立危险因素,说明交感神经激活对CABG术后AF的发生有重要作用。国内外学者通过长期右房起搏形成AF模型动物研究发现,与对照组相比,试验动物(犬)心房肌中交感神经增生显著和交感神经分布密度增加,可能使心房肌重构作用加强,提示局部交感神经活性增加和交感神经不均一性在房颤的诱导和维持中起重要作用[18,19]。
交感神经过度激活增加钙内流,可使心肌的异常自律性增高和触发活动增强,同时能缩短心房有效不应期(ERP),增加ERP离散度,导致细胞超级化,减小心房折返环的波长,增加心房的异质性,从而诱发房颤。 2012年Zhao等[20]报道用犬的AF模型快速心房起搏(800次/分)7小时后,肾动脉去交感神经组较假手术组的AF诱发次数和诱发出AF的持续时间明显减少,同时伴随循环中肾素、血管紧张素Ⅱ、醛固酮水平显著降低。Linz[21]等建立猪的阻塞性呼吸睡眠暂停(OSA)模型,通过双侧肾脏去神经化能改善OSA诱导的心房有效不应期的缩短和血压的升高,从而降低房颤的可诱发率,发挥抗心律失常作用。在另一个实验中,Linz[22]等通过给猪行双侧肾动脉去交感化能显著缩短快速心房起搏导致的房颤持续时间。因此,我们认为肾动脉去交感神经治疗能通过改善血压控制,降低交感神经活性对高血压伴AF患者发挥较理想的治疗效果。
我国人群高血压呈现“知晓率(30.2%)、治疗率(24.7%)、控制率偏低(6.1%),发病率增长迅速”的局面[23]。医学科学家一直寻找原发性高血压治疗的新策略,希望能“一劳永逸”地治疗高血压病,无需长期服药,持续有效降压,以减少高血压病引起的靶器官损害。澳大利亚Krum[24-26]学者以自主神经系统在高血压发生及维持中的病理生理学基础为立足点,将现代导管技术和射频消融技术应用到顽固性高血压的治疗之中,创立了高血压肾动脉去交感神经导管消融术(Renal Sympathetic Denervation, RSD)这一新的非药物治疗方法,2009年报道了153名顽固性高血压患者行RSD治疗(SimplicityHTN1)结果,随访2年血压平均降低32/12mmHg ;2010年再次报道106例顽固性高血压患者(SimplicityHTN2)进行了为期两年的随机对照研究,结果证实RSD组获得了确切而持久的降压效果,至1年随访时间结束时该组血压平均下降了28/10mmHg,而对照组(药物治疗)血压下降不明显。Witkowski [27]等同样对10例顽固性高血压伴葡萄糖耐量异常和阻塞性睡眠呼吸暂停综合症患者进行了RSD治疗,随访6个月发现在血压下降的同时患者葡萄糖代谢和呼吸睡眠障碍程度明显改善。除了已知的对血压血糖的影响,澳大利亚学者[28]入选46例顽固性高血压患者行RSD治疗,术后随访6个月心脏超声显示室间隔厚度从14.1mm降到12.5 mm(p=0.07),左室质量指数从112.4g/m2降到94.9 g/m2 (p<0.001),左房内径从45.2mm降到42.5mm(p<0.001),左室等容舒张时间从109.1ms降到85.6ms(p<0.001),同时反映心室舒张功能的指标二尖瓣舒张早期血流速度/二尖瓣外环舒张早期运动速度(E/Em)从9.9 ± 4.0 降低到 7.9 ± 2.2(p<0.001),射血分数明显提高(63.1% VS 70.1%,p<0.001),而对照组上述指标均无明显变化,第一次临床研究证实RSD在短期内能明显减轻高血压患者左室肥厚、左房扩大和改善心室舒张功能,说明RSD对心脏具有逆重构功能。Schlaich等[29]为一名59岁男性顽固性高血压患者行RSD,术后一个月不仅降低肾脏而且降低整个机体的去甲肾上腺素水平(降低42%),同时肌肉交感神经活性在随访的一年时间里呈持续性降低状态接近正常水平。而高血压、糖尿病、阻塞性睡眠呼吸暂停综合症、左室肥厚、心房扩大和去甲肾上腺素本身都是AF发生的独立危险因素。2012年9月Pokushalov[30]等在JACC报道27例顽固性高血压伴有症状AF病人随机双盲临床试验,随机分为RSD +环肺静脉隔离术(PVI)组(13人)和单纯PVI组(14人),术后随访一年后发现RSD+PVI组有9人AF无复发且所有治疗病人的血压得到明显控制,而单纯PVI组只有4人AF无复发且血压无变化(69% VS 29%)。同一期编者评述质疑:既往心房内导管消融治疗AF是否弄错了靶器官 [31 ]。最近,德国学者报道[32],一个顽固性高血压伴症状性和药物难控制的持续性AF患者,术前使用乙胺碘呋酮(amiodarone)负荷剂量下行电复律未能转复,行RSD术后再给乙胺碘呋酮药物自然复律,术后3-6个月随访一直维持窦性心律,而且心悸胸痛症状明显缓解,血压显著下降,同时心脏超声显示左心房直径明显缩小 。已发表文献表明RSD对心血管疾病有多种作用,如图1所示[33 ]。故在理论上,RSD去神经治疗一方面能控制房颤的危险因素,不仅阻断而且逆转心房重构,另一方面阻断交感神经系统和RAAS过度激活,从根本上防止房颤发生,可能为AF患者提供新的安全而有效的非药物治疗选择,而目前尚无RSD技术在AF治疗领域的相关临床研究,RSD对机体其他各系统交感神经活性及相应生理功能或病理生理机制的影响尚不明确,RSD治疗对AF患者心房重构、心肌纤维化、心功能、健康状态等的影响尚不清楚。这一系列问题的解决过程即为RSD技术在AF治疗领域应用的临床循证历程,也是逐渐凸显RSD在心血管疾病治疗方面潜在临床价值的过程。
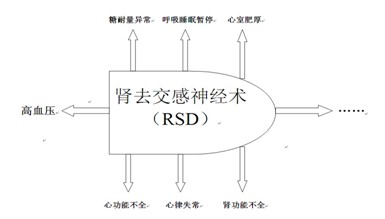
图1 已发表文献表明RSD术对心血管疾病的多重治疗作用
心房内射频导管消融只是针对AF“基质”,即使一次消融去除“基质”,并没有针对AF发生的病因和危险因素进行干预,心房结构和电重构持续性进展(心房心肌病)形成恶性循环,可能出现新“基质”再发AF,因此,心房内射频导管消融治疗AF是治标不治本,长期随访复发率高成功率低。实际上,每人都存在AF“基质”肺静脉肌袖,无高血压、心室肥厚和左房扩大等这些危险因素,除特发性AF,并无发作AF的风险。RSD对于高血压患者具有明确有效降血压、降低左室肥厚和左房大小;改善心室舒张功能、葡萄糖代谢异常和呼吸睡眠障碍功能,同时还有降低局部肾脏和整个机体的去甲肾上腺素水平,从而防治心房结构与电重构,甚至逆重构,从病因和危险因素上控制AF的发生和维持,可谓标本兼治。
美敦力公司(Medtronic)在今年1月9日宣布SYMPLICITY HTN-3没有能够达到预期的降压有效性终点(6个月诊室血压下降≧10mmHg),但这个实验达到了预期的首要安全指标,并且该实验的数据安全监测委员会得出结论:该实验中不存在安全性问题。很多专家质疑术者操作手法、所用能量较低(8W)和两侧肾动脉消融点数(每侧4-6点)较少,从而导致肾去交感神经不充分,引起降压效果不佳。目前这些结果还未在正式刊物上发表。最近Kaiser[34]报道93例顽固性高血压病患者用SYMPLICITY 导管行RSD注册研究,随访6个月74%患者有效(诊室血压下降大于10mmHg作为有效标准);24例(26%)患者血压未达到上述标准,对其中8例无反应性者(未达标者)行再次RSD术,其中5例患者6月随访时血压下降大于10mmHg。他们分析部分第一次RSD手术效果差的原因可能是术中未破坏掉足够数量的交感神经。
综上所述,本项目旨在通过对RSD的基础和临床研究,探讨高血压伴症状性AF患者RSD治疗AF可行性、安全性和有效性;希望通过此项研究为AF的RSD这一非药物治疗方法提供理论基础和临床实践指导。《肾去交感神经导管射频消融治疗高血压病伴症状性房颤》这一前瞻性临床研究已得到江苏省人民医院伦理委员会批准(伦理号:2012-SR-080),已获美国食品药物管理局和国立卫生研究院( FDA & NIH )临床试验官方网站注册批准和发表(注册号:NCT01713270)[35] 。
主要参考文献
1. Fuster V, Ryden LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA, Halperin JL, Kay GN, Le Huezey JY, Lowe JE, Olsson SB, Prystowsky EN, Tamargo JL, Wann LS, Smith SJ, Priori SG, Estes NR, Ezekowitz MD, Jackman WM, January CT, Lowe JE, Page RL, Slotwiner DJ, Stevenson WG, Tracy CM, Jacobs AK, Anderson JL, Albert N, Buller CE, Creager MA, Ettinger SM, Guyton RA, Halperin JL, Hochman JS, Kushner FG, Ohman EM, Stevenson WG, Tarkington LG, Yancy CW, 2011 ACCF/AHA/HRS focused updates incorporated into the ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines, Circulation, 2011, 123, e269-e367.
2. Cosedis NJ, Johannessen A, Raatikainen P, Hindricks G, Walfridsson H, Kongstad O, Pehrson S, Englund A, Hartikainen J, Mortensen LS, Hansen PS, Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation, N Engl J Med, 2012, 367, 1587-1595.
3. Tilz RR, Rillig A, Thurm AM, Arya A, Wohlmuth P, Metzner A, Mathew S, Yoshiga Y, Wissner E, Kuck KH, Ouyang F, Catheter ablation of long-standing persistent atrial fibrillation: 5-year outcomes of the hamburg sequential ablation strategy, J Am Coll Cardiol, 2012, 60(19), 1921-1929.
4. Burkhardt DJ, Biase LD, Natale A, Long-standing persistent atrial fibrillation: the metastatic cancer of electrophysiology, J Am Coll Cardiol, 2012, 60(19), 1930-1932.
5. Calkins H, Kuck KH, Cappato R, Brugada J, Camm AJ, Chen SA, Crijns HJ, Damiano RJ, Davies DW, DiMarco J, Edgerton J, Ellenbogen K, Ezekowitz MD, Haines DE, Haissaguerre M, Hindricks G, Iesaka Y, Jackman W, Jalife J, Jais P, Kalman J, Keane D, Kim YH, Kirchhof P, Klein G, Kottkamp H, Kumagai K, Lindsay BD, Mansour M, Marchlinski FE, McCarthy PM, Mont JL, Morady F, Nademanee K, Nakagawa H, Natale A, Nattel S, Packer DL, Pappone C, Prystowsky E, Raviele A, Reddy V, Ruskin JN, Shemin RJ, Tsao HM, Wilber D, 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design: a report of the Heart Rhythm Society (HRS) Task Force on Catheter and Surgical Ablation of Atrial Fibrillation. Developed in partnership with the European Heart Rhythm Association (EHRA), a registered branch of the European Society of Cardiology (ESC) and the European Cardiac Arrhythmia Society (ECAS); and in collaboration with theAmericanCollegeof Cardiology (ACC), American Heart Association (AHA), the Asia Pacific Heart Rhythm Society (APHRS), and the Society of Thoracic Surgeons (STS). Endorsed by the governing bodies of theAmericanCollegeof Cardiology Foundation, the American Heart Association, the European Cardiac Arrhythmia Society, the European Heart Rhythm Association, the Society of Thoracic Surgeons, the Asia Pacific Heart Rhythm Society, and the Heart Rhythm Society, Heart Rhythm, 2012, 9, 632-696.
6. Healey JS, Connolly SJ, Atrial fibrillation: hypertension as a causative agent, risk factor for complications, and potential therapeutic target, Am J Cardiol, 2003, 91,9G-14G.
7. Grundvold I, Skretteberg PT, Liestøl K, Erikssen G, Kjeldsen SE, Arnesen H, Erikssen J, Bodegard J, Upper Normal Blood Pressures Predict Incident Atrial Fibrillation in Healthy Middle-Aged Men: A 35-Year Follow-Up Study, Hypertention, 2012, 59, 198-204.
8. Kalifa J, Jalife J, Zaitsev AV, Bagwe S, Warren M, Moreno J, Berenfeld O, Nattel S, Intra-atrial pressure increases rate and organization of waves emanating from the superior pulmonary veins during atrial fibrillation, Circulation, 2003, 108, 668-671.
9. Kannel WB, Wolf PA, Benjamin EJ, Levy D, Prevalence, incidence, prognosis, and
predisposing conditions for atrial fibrillation: population-based estimates, Am J Cardiol,
1998, 82, 2N-9N.
10. 赵文雪,杨兵,陈明龙,居维竹,陈红武,翟立上,张凤祥,雍永红,单其俊,邹建刚,陈椿,侯小锋,曹克将,左心房压与心房颤动类型和导管消融术后复发的关系,中华心律失常学杂志,2010,14(6),417-420.
11. Burstein B, Nattel S, Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation, J Am Coll Cardiol, 2008, 51, 802-809.
12. Patterson E, Lazzara R, Szabo B, Liu H, Tang D, Li YH, Scherlag BJ, Po SS, Sodium-calcium exchange initiated by the Ca2+ transient: an arrhythmia trigger within pulmonary veins, J Am Coll Cardiol, 2006, 47,1196-1206.
13. Sharifov OF, Fedorov VV, Beloshapko GG, Glukhov AV, Yushmanova AV, Rosenshtraukh LV, Roles of adrenergic and cholinergic stimulation in spontaneous atrial fibrillation in dogs, J Am Coll Cardiol, 2004, 43, 483-490.
14. Oral H, Crawford T, Frederick M, Gadeela N, Wimmer A, Dey S, Sarrazin JF, Kuhne M, Chalfoun N, Wells D, Good E, Jongnarangsin K, Chugh A, Bogun F, Pelosi FJ, Morady F, Inducibility of paroxysmal atrial fibrillation by isoproterenol and its relation to the mode of onset of atrial fibrillation, J Cardiovasc Electrophysiol, 2008, 19, 466-470.
15. Kuhlkamp V, Schirdewan A, Stangl K, Homberg M, Ploch M, Beck OA, Use of metoprolol CR/XL to maintain sinus rhythm after conversion from persistent atrial fibrillation: a randomized, double-blind, placebo-controlled study, J Am Coll Cardiol, 2000, 36, 139-146.
16. Nergardh AK, Rosenqvist M, Nordlander R, Frick M, Maintenance of sinus rhythm with metoprolol CR initiated before cardioversion and repeated cardioversion of atrial fibrillation: a randomized double-blind placebo-controlled study, Eur Heart J, 2007, 28, 1351-1357.
17. 沈童童,单其俊 *,袁彪,杨兵,徐东杰,陈椿,邹建刚,陈明龙,曹克将, 冠状动脉旁路移植术后心房颤动的发生率及其危险因素分析, 中国心脏起搏与心电生理杂志, 2007, 3(21), 215-218.
18. Chang CM, Wu TJ, Zhou S, Doshi RN, Lee MH, Ohara T, Fishbein MC, Karagueuzian HS, Chen PS, Chen LS, Nerve sprouting and sympathetic hyperinnervation in a canine model of atrial fibrillation produced by prolonged right atrial pacing, Circulation, 2001, 103, 22-25.
19. Yi Z, Zhang HC, Zhang P, Liu G, Lu P, Sun JL, Liu B, Guo JH, The relationship of paroxysmal atrial fibrillation and regional sympathetic innervations in the atria and pulmonary veins: experiment with dogs, Zhonghua Yi Xue Za Zhi, 2007, 87, 3433-3435.
20. Zhao Q, Yu S, Zou M, Dai Z, Wang X, Xiao J, Huang C, Effect of renal sympathetic denervation on the inducibility of atrial fibrillation during rapid atrial pacing, J Interv Card Electrophysiol, 2012, 35, 119-125.
21. Linz D, Mahfoud F, Schotten U, Ukena C, Neuberger HR, Wirth K, Bohm M, Renal sympathetic denervation suppresses postapneic blood pressure rises and atrial fibrillation in a model for sleep apnea, Hypertension, 2012, 60, 172-178.
22. Linz D, Mahfoud F, Schotten U, Ukena C,Hohl M, Neuberger HR, Wirth K, BohmM,
Renal sympathetic denervation provides ventricular rate control but does not prevent atrial
electrical remodeling during atrial fibrillation, Hypertension, 2013, 61(1), 225-231.
23. 刘力生,中国高血压防治指南2010,中华心血管病杂志,2011,39(7),579-632.
24. Krum H, Schlaich M, Whitbourn R, Sobotka PA, Sadowski J, Bartus K, Kapelak B, Walton A, Sievert H, Thambar S, Abraham WT, Esler M, Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study, Lancet 2009, 373, 1275-1281.
25. Krum H, Barman N, Schlaich M, Catheter-Based Renal Sympathetic Denervation for Resistant Hypertension Durability of Blood Pressure Reduction Out to 24 Months, Hypertension, 2011, 57, 911-917.
26. Esler MD, Krum H, Schlaich M, Schmieder RE, Bohm M, Sobotka PA, Renal Sympathetic Denervation for Treatment of Drug-Resistant Hypertension: One-Year Results from the Symplicity HTN-2 Randomized Controlled Trial, Circulation, 2012, 126, 2976-2982.
27. Witkowski A, Prejbisz A, Florczak E, Kadziela J, Sliwinski P, Bielen P, Michalowska I, Kabat M, Warchol E, Januszewicz M, Narkiewicz K, Somers VK, Sobotka PA, Januszewicz A, Effects of renal sympathetic denervation on blood pressure, sleep apnea course, and glycemic control in patients with resistant hypertension and sleep apnea, Hypertension, 2011, 58, 559-565.
28. Brandt MC, Mahfoud F, Reda S, Schirmer SH, Erdmann E, Bohm M, Hoppe UC, Renal sympathetic denervation reduces left ventricular hypertrophy and improves cardiac function in patients with resistant hypertension, J Am Coll Cardiol, 2012, 59, 901-909.
29. Schlaich MP, Sobotka PA, Krum H, Lambert E, Esler MD, Renal sympathetic-nerve ablation for uncontrolled hypertension, N Engl J Med, 2009, 361, 932-934.
30. Pokushalov E, Romanov A, Corbucci G, Artyomenko S, Baranova V, Turov A, Shirokova N, Karaskov A, Mittal S, Steinberg JS, A randomized comparison of pulmonary vein isolation with versus without concomitant renal artery denervation in patients with refractory symptomatic atrial fibrillation and resistant hypertension, J Am Coll Cardiol, 2012, 60, 1163-1170.
31. Verdino RJ, Catheter Ablation for the Treatment of Atrial Fibrillation: Have We Been Targeting the Wrong Organ? J Am Coll Cardiol, 2012, 60(13), 1171-72.
32. Vollmann D, Sossalla S, Schroeter MR, Zabel M, Renal artery ablation instead of
pulmonary vein ablation in a hypertensive patient with symptomatic, drug-resistant,
persistent atrial fibrillation, Clin Res Cardiol, 2012, Dec 14.
33. 汪强(研究生),单其俊(通迅),经皮肾去交感神经导管射频消融术的临床研究进展,中国心脏起搏与心电生理杂志,2012;26:471-476
34.Kaiser L, Beister T, Wiese A, von Wedel J, Meincke F, Kreidel F, Busjahn A, Kuck KH,Bergmann MW: Results of the ALSTER BP real-world registry on renal denervation employing the Symplicity system. EuroIntervention : journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2014.
35.Shan Qijun, Renal sympathetic denervation in patients with hypertension and symptomatic atrial fibrillation(RSDforAF), http://clinicaltrials.gov/, NCT01713270, OCT 2012.
《医心评论》独家所有,请勿转载!转载请标明出处!
来源: 医心评论





 京公网安备 11010102002968号
京公网安备 11010102002968号