医疗器械临床试验设计中的统计学挑战
发布于:2013-10-18 17:36
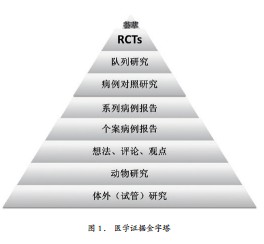
众所周知,在临床研究中,医学证据级别是呈现金字塔式的(图1),位于塔底部分的往往是一些动物实验、评论及个案研究等,单个研究最高级别的是随机对照试验(Randomized Controlled Trial,RCT)。塔尖部分则是由多个设计良好的随机对照研究组成的荟萃分析(Meta-Analysis)。良好设计的随机对照试验是临床研究的金标准。因此,这种试验设计方法在药物临床中得到了非常广泛的运用。但是器械临床试验的设计能够沿用药物临床试验的设计吗?要回答这个问题,我们首先来了解一下器械与药物的区别有哪些:
6. 法规要求不同:药物需要进行I-IV 期的多个临床试验,对于器械,只需要一个确证性研究。
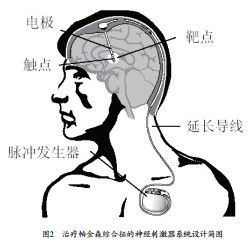
1. 神经刺激器系统用于治疗多种药物治疗无效的帕金森综合征(图2)
帕金森综合征是中老年人最常见的一种中枢神经系统变性疾病,迄今为止对本病的治疗均为对症治疗,但尚无根治方法可以使变性的神经细胞恢复。图2展示了一种用于多种药物治疗无效的帕金森综合征的神经刺激器系统。由于这是一种植入系统,要进行对照试验,在操作上不可行,因为目前国内还没有类似的器械或有效的药物;在伦理上也不可行,因为植入后疗效立即显现,且与不治疗相比疗效差距巨大,因此也无法实施盲法。因此,传统的随机对照试验对此行不通。这时,我们就要考虑单组目标值法这种试验设计方法了。但问题是,目标值该如何选取?这是我们需要考虑的首要问题,这对统计学家、临床专家及法规部门都是一个挑战。
的选择偏倚等。如何控制这些偏倚?这也是我们需要面对的挑战。
和 MRI 机的诊断效果,我们就需要同一个患者经历两次辐射。一次被试X射线机、一次对照X射线机。由于辐射对人体有很大的伤害,这样设计的试验,肯定会带来伦理问题。
- 罕见病例,样本量应满足哪些统计学要求?
量的问题。鉴于欧美发达国家法规部门的经验,应该针对不同医疗器械产品的特性,分别制定产品临床试验的指导原则,以解决生产企业在产品注册过程中所遇到的统计学设计问题。只有当研发产品在安全的前提下,其有效性既具有临床意义,又具有统计学意义时,所研发的产品性能才具有人群的意义,能够用于真实临床实践中具有相同适应证患者的治疗。
来源于:《医心评论》第66期





 京公网安备 11010102002968号
京公网安备 11010102002968号